题目内容
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。
(1)铁离子的价层电子排布图为_____________________。
(2)碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是_________。
(3)1mol 苯分子中含有σ键的数目为_________。
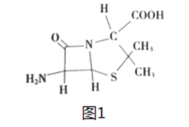
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是____________________。
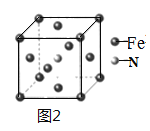
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式______________________________。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(-![]() ,-
,-![]() ,0);B处为(0,0,0);则C处微粒的坐标参数为___________。
,0);B处为(0,0,0);则C处微粒的坐标参数为___________。
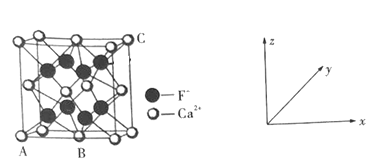
②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为______g·cm-3,(NA为阿伏加德罗常数的值,用含a、NA的式子表示)。
【答案】 C>SiC>Si 12NA O>N>S>C Fe4N (
C>SiC>Si 12NA O>N>S>C Fe4N (![]() )
) ![]()
【解析】
(1)铁是26号元素,基态原子核外有26个电子,根据构造原理,原子核外电子排布式为:1s22s22p63s23p63d64s2,3d、4s能级上电子是其价电子,故铁离子(Fe3+)的价层电子排布图 ,故本题答案为:
,故本题答案为: ;
;
(2)原子晶体的熔点高低和共价键键能有关,已知键长:C-C<C-Si<Si-Si,键长越小,键能越大,熔点越高,所以熔点大小为金刚石>碳化硅>硅,故本题答案为:C>SiC>Si。
(3)一个苯环分子内:相邻的每两个碳原子间有一个σ键,共6个;苯环与氢原子间有1个σ键,共6个;一苯环分子共12个σ键,1mol苯分子中含有12NA个σ键,故本题答案为:12NA;
(4)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片可知,采用sp3杂化的原子有C、N、O、S,电负性大小为:O>N>S>C,故本题答案为:O>N>S>C;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,故本题答案为:Fe4N;
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,故本题答案为:Fe4N;
(6)①B处于底面面心上,C位于顶点上,则由A的坐标参数可知,晶胞棱长=1,C点的坐标参数为(![]() ),故本题答案为(
),故本题答案为(![]() );
);
② 由于F-位于晶胞的内部,Ca2+位于晶胞的顶点和面心,所以平均每个晶胞含有F-和Ca2+数目分别是8个和4个,晶胞的边长为a×10-10cm,所以ρ=![]() g·cm-3=
g·cm-3= ![]() g·cm-3,故本题答案为:
g·cm-3,故本题答案为:![]() 。
。

【题目】碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
![]()
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____(填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
序号 | 实验 | 操作 | 现象 |
Ⅰ |
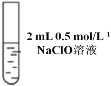
| 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
Ⅱ |
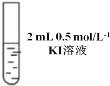
| 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2 在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因: __________(用离子方程式表示)。
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________。
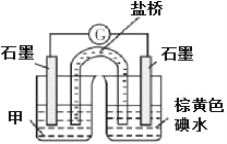
③小组同学又设计了如下实验:
序号 | 实验 | 操作 | 现象 |
Ⅳ |
| 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因 _____________。
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。