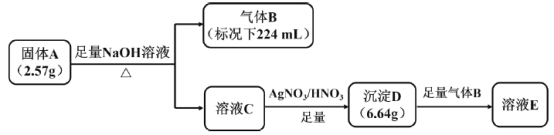
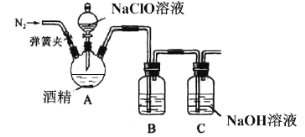
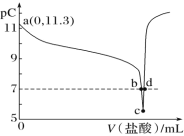
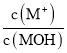题目内容
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
【答案】5.0 量筒 温度计 4.0 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=﹣53.5kJ/mol 偏大
Na2SO4(aq)+H2O(l)△H=﹣53.5kJ/mol 偏大
【解析】
(1) 配制230mL NaOH溶液,需要选用250mL的容量瓶;
(2)缺少量取溶液体积的量筒、测量温度的温度计;
(3) ①4次实验温度的差值分别为4.1℃、4.8℃、3.9℃、4.0℃,第二次数据差距较大,舍弃数据;
②根据Q=c![]() m
m![]() t、
t、![]() H=- Q/n进行计算;
H=- Q/n进行计算;
(4)若用氨水代替NaOH做实验,氨水为弱碱,电离时吸收热量。
(1) 配制230mL NaOH溶液,需要选用250mL的容量瓶,m(NaOH)=0.50mol/L![]() 0.25L
0.25L![]() 40g/mol=5.0g;
40g/mol=5.0g;
(2)缺少量取溶液体积的量筒、测量温度的温度计;
(3) ①4次实验温度的差值分别为4.1℃、4.8℃、3.9℃、4.0℃,第二次数据差距较大,舍弃数据,则3次数据的平均值为(4.1+3.9+4.0)/3=4.0℃;
②Q=c![]() m
m![]() t=4.18
t=4.18![]() 80
80![]() 4.0=1337.6J,中和反应为放热反应,则
4.0=1337.6J,中和反应为放热反应,则![]() H=- Q/n=-1.3376kJ/0.025mol=-53.5kJ/mol;
H=- Q/n=-1.3376kJ/0.025mol=-53.5kJ/mol;
(4)若用氨水代替NaOH做实验,氨水为弱碱,电离时吸收热量,导致中和时释放的热量减少,焓变偏大。

 名校课堂系列答案
名校课堂系列答案【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
【题目】食用白醋的有效成分为醋酸(CH3COOH),可使用酸碱中和滴定法进行测定。现用标准NaOH溶液测定市售“上海白醋”的总酸量(g/100mL)。请填写实验报告中的空白处。
(实验目的)测定市售“上海白醋”的总酸量
(实验用品)蒸馏水,上海白醋,0.1000mol/LNaOH标准溶液,酚酞;100mL容量瓶,___________,玻璃棒,滴定管,锥形瓶,烧杯,铁架台及附件。
(实验步骤)
(1)配制并移取待测食醋溶液:
①用___________(填仪器名称)量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得。
②取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴酚酞作指示剂。
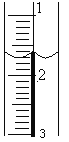
(2)盛装标准NaOH溶液:滴定管经过洗涤后,装入NaOH标准溶液,使液面位于________________________________,记录滴定管的初读数。若液面位置如图所示,则此时的读数为____________mL。
(3)滴定:当_____________________________________________时即为滴定终点。滴定到达终点后记录NaOH溶液的终点读数。再重复滴定3次。
(数据记录与处理)
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测食醋体积/mL | 20.00 | 20.00 | 20.00 | 20.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 15.95 | 16.20 | 15.15 | 16.20 |
(4)甲同学在处理数据时计算得:消耗NaOH溶液的平均体积(V)=![]() =15.76 mL,指出计算的不合理之处:____________________________________________,
=15.76 mL,指出计算的不合理之处:____________________________________________,
(5)按正确数据处理计算,“上海白醋”的总酸量=___________g/100mL。
(思考与讨论)
(6)查看瓶示:总酸≥5g/100mL(以醋酸计),则此次测量的相对误差至少为________。
(7)下列操作中可能造成该测量误差的是____________(填序号)。
a. 未用标准NaOH溶液润洗滴定管 b. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
c. 滴定前未赶走滴定管尖嘴中的气泡 d. 锥形瓶中加入待测白醋溶液后,再加少量水