��Ŀ����
����Ŀ�����Ȼ�����SnCl4���������л�������������������������ijѧϰС�����ø�������������ڵ����Ʊ� SnCl4 ���ⶨ��Ʒ�Ĵ��ȡ�

��֪��i��SnCl4 �ڿ����м���ˮ��� SnO2��xH2O��ii���й����ʵ������������±���ʾ��
���� | ��ɫ | �۵�/�� | �е�/�� |
Sn | ����ɫ | 232 | 2260 |
SnCl2 | ��ɫ | 247 | 652 |
SnCl4 | ��ɫ | -33 | 114 |
�ش��������⣺
(1)װ�� E ������������_____��װ�� C ��ʢ�ŵ��Լ���_____��
(2)װ�� G ��������_____��
(3)ʵ�鿪ʼʱ����ȷ�IJ���˳��Ϊ_____��
�ٵ�ȼװ�� A ���ƾ��� �ڵ�ȼװ�� D ���ƾ��� �۴�Һ©������
(4)�õ��IJ�Ʒ�Ի�ɫ����������_____�����������м��뵥��___________�����������ƣ�����ȥ��Ϊ�˽�һ�������ᴿ��Ʒ����ȡ�IJ���������_____��
(5)��Ʒ�к����� SnCl2���ⶨ��Ʒ���ȵķ�����ȡ 0.400 g ��Ʒ��������ϡ�����У����������Һ��ָʾ������ 0.0100 mo/L ����ر���Һ�ζ����յ㣬���ı�Һ 8.00 mL ��
�ٵζ�ԭ�����£���� i ��Ӧ�����ӷ���ʽ��
i��_____Sn2++_____IO3��+_____H+= ________Sn4++_____I��+_____
ii��IO3��+5 I2��+6H+ = 3I2 + 3HO
�ڵζ��յ��������_____��
�۲�Ʒ�Ĵ���Ϊ_____%������һλС������
���𰸡������� Ũ���ᣨŨ H2SO4�� ���ն���� Cl2����ֹ��Ⱦ���������տ����е�ˮ��������ֹ��Ʒˮ�� �ۢ٢� Cl2 �� ���� 3 1 6 3 1 3H2O ��ƿ����Һ����ɫ��Ϊ��ɫ������Ӳ���ɫ 88.6
��������
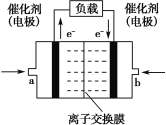
��Aװ���У�MnO2��Ũ�����ڼ��������·�Ӧ����Cl2������Ũ�����ӷ����������ɵ�Cl2�л���HCl�����ˮ������Bװ���У�����ʳ��ˮ�ɳ�ȥCl2�е�HCl��Cװ�����ڸ���Cl2������Ӧ����Ũ������ž�װ���ڵĿ�������Dװ�ã�������Cl2��Ӧ����SnCl4��������������������Fװ���ռ���ͬʱ��Gװ������δ��Ӧ��Cl2������ֹ�����е�ˮ��������F�У�����SnCl4��ˮ�⡣
(1)װ�� E �����������������ܣ������Ϸ���֪��װ�� C ���ڸ���������Ӧʢ�ŵ��Լ���Ũ���ᣨŨ H2SO4������Ϊ�������ܣ�Ũ���ᣨŨ H2SO4����
(2)װ�� G �ȿɷ�ֹ��������������ֿɷ�ֹ�����е�ˮ��������װ�ã����������������ն���� Cl2����ֹ��Ⱦ���������տ����е�ˮ��������ֹ��Ʒˮ�⡣��Ϊ�����ն���� Cl2����ֹ��Ⱦ���������տ����е�ˮ��������ֹ��Ʒˮ�⣻
(3)ʵ�鿪ʼʱ��Ӧ�ȼ�ҩƷ���������������Sn��Cl2�ķ�Ӧ��������ȷ�IJ���˳��Ϊ�ۢ٢ڡ���Ϊ���ۢ٢ڣ�
(4)�õ��IJ�Ʒ�Ի�ɫ����������Cl2�����������м��뵥������������Cl2��Ӧ����SnCl4��ȥ������Ϣ��֪������SnCl2�ķе��SnCl4�ߣ��ɲ�ȡ�IJ�������������Ϊ��Cl2����������
(5)�����õ�ʧ�����غ���ƽʱ�������京���Ԫ�����Ļ�ѧ�������������õ���غ㡢�����غ����������ʵĻ�ѧ���������Ӷ��õ���ƽ�ķ���ʽΪ��3Sn2++IO3��+6H+= 3Sn4++I��+3H2O����Ϊ��3��1��6��3��1��3H2O��
�ڵζ��յ�ʱ��������ӦIO3��+5 I2��+6H+ = 3I2 + 3HO�����ɵ�I2ʹ���۱������Ӷ��ó���������������ƿ����Һ����ɫ��Ϊ��ɫ������Ӳ���ɫ����Ϊ����ƿ����Һ����ɫ��Ϊ��ɫ������Ӳ���ɫ��
���ɷ�Ӧ����ʽ�ɵù�ϵʽ��3Sn2+����IO3����n(Sn2+)=3n(IO3-)=3��0.0100 mo/L��8.00��10-3 L=2.4��10-4mol����Ʒ�Ĵ���Ϊ![]() =88.6%����Ϊ��88.6��
=88.6%������88.6��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�����Ŀ�����������ˮ��Һ�еĵ���״�����Խ��ж���������Ʋ⡣
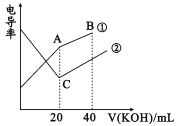
��1��25��ʱ������ĵ���ƽ�ⳣ�������ʾ��
Ka1 | Ka2 | |
HA | 1��10-4 | |
H2B | 1��10-2 | 5��10-6 |
��25��ʱ��0.100mol��L-1��NaA��Һ��H+��OH-��Na+��A-��HA�����ʵ���Ũ���ɴ�С��˳���ǣ�___��pH=8��NaA��Һ����ˮ�������c(OH-)=___mol��L-1��
��25��ʱ��0.100mol��L-1��NaHB��ҺpH___7��������___��
��25��ʱ����0.100mol��L-1��Na2B��Һ�еμ�����0.100mol��L-1��HA��Һ����Ӧ�����ӷ���ʽΪ___��
��2����֪25��ʱ����0.100mol��L-1��H3PO4��Һ�еμ�NaOH��Һ���������������ʵ���������pH�仯�Ĺ�ϵ��ͼ��ʾ��
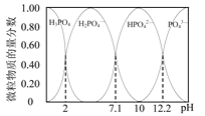
�ٵ���ҺpH��11��14ʱ����������Ӧ�����ӷ���ʽΪ��___��
����Ŀ�������������һ�ֿɴٽ�����������Ӫ�����ʡ���ȡ��������Ƶ��������¡�
![]()
��֪��a.CH2OH(CHOH)4CHO+Br2+H2O��C6H12O7(��������)+2HBr��
b.2C6H12O7(��������)+CaCO3��Ca(C6H11O7)2(���������)+H2O+CO2����
c.������ʵ��ܽ��Լ��±���
�������� | ��������� | �������� | �廯�� | �Ȼ��� |
��ˮ�е��ܽ��� | ��������ˮ����������ˮ | ���� | ���� | ���� |
���Ҵ��е��ܽ��� | �� | �� | ���� | ���� |
d.���ԣ�����������̼�ᡣ
��ش��������⡣
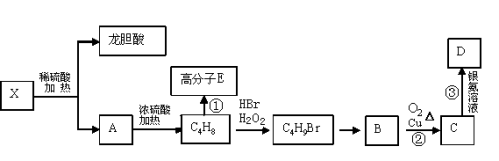
��1���Ʊ�����������漰�ķ�Ӧ������__��
��2���ڢٲ�����ˮ����������ʱ������װ������ʵ���__������ţ���
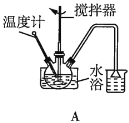
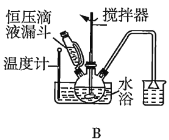
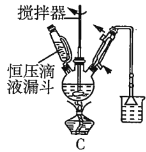
��3���ڢڲ���ӦCaCO3�������ԭ����__��
��4����ʵ���в�����CaCl2���CaCO3��������__��
��5���ڢ۲�����ȹ��ˣ���ԭ����__��
��6�����Ʊ�ʱ��������Һ�к���9.0g�����ǣ�����ߺ�õ�8.2g��������ƣ�����������ƵIJ���Ϊ__��