题目内容
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲,乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T3 |
起始量 | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |
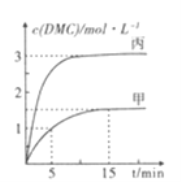
甲容器中,在5-15min时的平均反应速率v(CO2)=___________.乙容器中,若平衡时n(CO2)=0.2mol.则T1_____T2 (填“>”“<”或“=”)。两容器的反应达平衡时CO2的转化率: 甲________丙(填“>”“<."或”=”)。
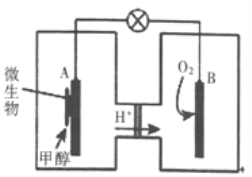
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示: A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。
【答案】 CO(g)+2H2(g)=CH3OH(g) ΔH=-99.7kJ·mol-1 ![]() AC 0.05mol·L-l·min-1 > > 负极 CH3OH-6e- +H2O=6H++CO2 高温能使微生物蛋白质凝固变性
AC 0.05mol·L-l·min-1 > > 负极 CH3OH-6e- +H2O=6H++CO2 高温能使微生物蛋白质凝固变性
【解析】试题分析:(1)根据盖斯定律计算由CO与H2制备CH3OH 气体焓变;(2)①根据化学平衡常数定义写表达式;②根据平衡标志分析;③根据图示,甲容器中,在5-15min时CH3OCOOCH3的浓度变化是0.5mol/L,则CO2的浓度变化为0.5mol/L;甲容器中,达到平衡时,CH3OCOOCH3的浓度是1.5mol/L,物质的量是1.5mol/L×0.5L=0.75mol,消耗CO20.75mol,剩余CO2 0.25mol;丙中2molCH3OH(g)生成CH3OCOOCH3的物质的量小于1mol,CH3OCOOCH3的平衡浓度是3mol/L,所以丙容器的体积小于![]() ;(3)燃料电池装置中氢离子移向B电极,所以B是正极、A是负极;负极甲醇失电子;高温能使微生物蛋白质变性。
;(3)燃料电池装置中氢离子移向B电极,所以B是正极、A是负极;负极甲醇失电子;高温能使微生物蛋白质变性。
解析:(1)①H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
②CO2(g)+H2(g) = CO(g)+H2O(l) ΔH2=-3.0kJ/mol
③CO2(g)+3H2(g) = CH,OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
根据盖斯定律③-②-①得 CO(g)+2H2(g)=CH3OH(g) ΔH=-99.7kJ·mol-1;(2)① 2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g)的平衡常数表达式是
CH3OCOOCH3(g)+H2O(g)的平衡常数表达式是![]() ;②V正(CH3OH)= 2V逆(H2O),正逆反应速率相等,所以达到平衡状态,故A正确;根据
;②V正(CH3OH)= 2V逆(H2O),正逆反应速率相等,所以达到平衡状态,故A正确;根据![]() ,气体密度是恒量,所以容器内气体的密度不变,不一定平衡,故B错误;反应前后气体系数和改变,压强是变量,所以容器内压强不变,一定达到平衡状态,故C正确;若甲醇、二氧化碳的初始投料比为2:1,则CH3OH与CO2的物质的量之比始终是2:1,所以CH3OH与CO2的物质的量之比保持不变,不一定平衡,故D错误。③根据图示,甲容器中,在5-15min时CH3OCOOCH3的浓度变化是0.5mol/L,则CO2的浓度变化为0.5mol/L,所以v(CO2)= 0.5mol/L÷10min=0.05mol·L-l·min-1;根据一边倒原则,甲乙投料相同;甲容器中,达到平衡时,剩余CO2 0.25mol,乙容器剩余CO2 0.2mol,甲乙相比,相当于乙平衡正向移动,正反应放热,所以温度T1>T2;丙中2molCH3OH(g)生成CH3OCOOCH3的物质的量小于1mol,CH3OCOOCH3的平衡浓度是3mol/L,所以丙容器的体积小于
,气体密度是恒量,所以容器内气体的密度不变,不一定平衡,故B错误;反应前后气体系数和改变,压强是变量,所以容器内压强不变,一定达到平衡状态,故C正确;若甲醇、二氧化碳的初始投料比为2:1,则CH3OH与CO2的物质的量之比始终是2:1,所以CH3OH与CO2的物质的量之比保持不变,不一定平衡,故D错误。③根据图示,甲容器中,在5-15min时CH3OCOOCH3的浓度变化是0.5mol/L,则CO2的浓度变化为0.5mol/L,所以v(CO2)= 0.5mol/L÷10min=0.05mol·L-l·min-1;根据一边倒原则,甲乙投料相同;甲容器中,达到平衡时,剩余CO2 0.25mol,乙容器剩余CO2 0.2mol,甲乙相比,相当于乙平衡正向移动,正反应放热,所以温度T1>T2;丙中2molCH3OH(g)生成CH3OCOOCH3的物质的量小于1mol,CH3OCOOCH3的平衡浓度是3mol/L,所以丙容器的体积小于![]() ;丙中CO2的转化率小于0.5,甲中CO2的转化率等于0.75 ,CO2的转化率甲>丙;(3)燃料电池装置中氢离子移向B电极,所以B是正极、A是负极;负极甲醇失电子,电极反应式是CH3OH-6e- +H2O=6H++CO2;高温能使微生物蛋白质变性,所以该电池不能在高温下工作。
;丙中CO2的转化率小于0.5,甲中CO2的转化率等于0.75 ,CO2的转化率甲>丙;(3)燃料电池装置中氢离子移向B电极,所以B是正极、A是负极;负极甲醇失电子,电极反应式是CH3OH-6e- +H2O=6H++CO2;高温能使微生物蛋白质变性,所以该电池不能在高温下工作。

【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
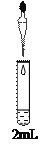
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。