题目内容
【题目】将Na2O2投入FeCl3溶液中, 可观察到的现象是( )
A.生成白色沉淀B.生成红褐色沉淀
C.有气泡产生D.无变化
【答案】BC
【解析】
将Na2O2投入FeCl3溶液中,Na2O2与水反应生成氢氧化钠、氧气和水,NaOH与FeCl3反应生成氢氧化铁红褐色沉淀,则观察到的现象为:有气泡生成,有红褐色沉淀产生,答案为BC。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲,乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T3 |
起始量 | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |
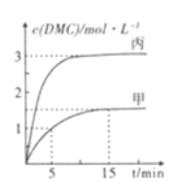
甲容器中,在5-15min时的平均反应速率v(CO2)=___________.乙容器中,若平衡时n(CO2)=0.2mol.则T1_____T2 (填“>”“<”或“=”)。两容器的反应达平衡时CO2的转化率: 甲________丙(填“>”“<."或”=”)。
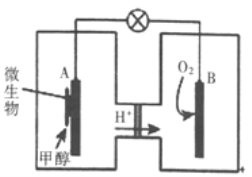
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示: A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。