题目内容
7. 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
(1)粉红色、不溶于水的Co(OH)2具有两性,其溶于盐酸的离子方程式为Co(OH)2+2H+=Co2++2H2O,Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3,反应的化学方
程式为4Co(OH)2+O2+2H2O=4Co(OH)3.
(2)CoxNi(1-x)Fe204(其中Co、Ni均为+2价)可用作H202分解的催化剂,具有较高的活性.
①该催化剂中铁元素的化合价为+3.
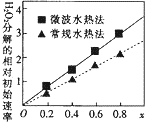
②两种不同方法制得的催化剂CoxNi(1-x)Fe204在10℃时催化分解6%的H202溶液的相对初始速率随X变化的曲线如图所示.由图中信息可知:微波水热法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果较好的是Co2+.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的氧化物(其中Co的化合价为+2、+3)制备,用480mL 5mol.I-1盐酸恰好将其完全溶解,得到CoCl2溶液和6.72L(标准状况下)黄绿色气体.则该钴的氧化物的化学式
为Co3O4.
分析 (1)类比氢氧化铝的两性回答即可,类比氢氧化亚铁的性质回答即可;
(2)①根据化合价代数和为0计算Fe的化合价;
②过氧化氢的分解速率越大,催化剂活性更高;随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大;一
(3)由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O).
解答 解:(1)Co(OH)2溶于盐酸生成氯化钴,离子反应方程式为:Co(OH)2+2H+=Co2++2H2O;Co(OH)2在空气中慢慢被氧化为棕褐色的Co(OH)3的方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,故答案为:Co(OH)2+2H+=Co2++2H2O;4Co(OH)2+O2+2H2O=4Co(OH)3;
(2)①CoxNi(1-x)Fe2O4中Co、Ni均为+2,O为-2价,则Fe的化合价为$\frac{4×2-(2x+2-2x)}{2}$=+3,故答案为:+3;
②过氧化氢的分解速率越大,催化剂活性更高,根据图象可知,x相同时,微波水热法初始速度大于常规水热法,故微波水热法制得催化剂的活性更高;由图可知,随x值越大,过氧化氢的分解速率越大,而x增大,Co2+的比例增大,故Co2+的催化活性更高,故答案为:微波水热;Co2+;
(3)由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{6.72L}{22.4L/mol}$=0.6 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×0.3mol)=0.9 mol,所以固体中的n(Co2+)=0.9mol-0.6mol=0.3 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.3mol×2+0.6mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=0.9mol:1.2mol=3:4,故氧化物的化学式为:Co3O4,故答案为:Co3O4.
点评 本题考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.

| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含质子数相等 | |
| C. | 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 | |
| D. | 12g C和16g O所含的原子数不相等 |
| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加HCl酸化的BaCl2有白色沉淀,一定有SO42- | |
| C. | 滴加硝酸酸化的AgNO3溶液没有白色沉淀,一定没有SO42- | |
| D. | 滴加BaCl2有白色沉淀,一定有SO42- |
| A. | 浓硝酸 | B. | 浓硫酸 | C. | 烧碱 | D. | 氢氟酸 |
| A. | 1mol任何物质都含有约6.02×1023个分子 | |
| B. | 0.012kg12C中含有约6.02×1023个碳原子 | |
| C. | 1molH2O2中含有约1mol H2和1molO2 | |
| D. | 阿伏加德罗常数没有单位 |
| A. | 过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol | |
| B. | 在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为$\frac{1}{4}$nmol | |
| C. | 在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极 | |
| D. | 碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物 |