题目内容
2.检验试样中有无SO42-的操作及结论正确的是( )| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加HCl酸化的BaCl2有白色沉淀,一定有SO42- | |
| C. | 滴加硝酸酸化的AgNO3溶液没有白色沉淀,一定没有SO42- | |
| D. | 滴加BaCl2有白色沉淀,一定有SO42- |
分析 硫酸根离子对检验方法是,取少许溶液,加入过量盐酸无明显现象,加入氯化钡有白色沉淀生成,证明含硫酸根.
解答 解:A、检验硫酸根离子的正确方法是先加入稀盐酸排除银离子的干扰,再加入氯化钡有白色沉淀,说明溶液中存在硫酸根,故A正确;
B、加HCl酸化的BaCl2有白色沉淀,如果原溶液中含银离子,也会产生不溶于酸的白色沉淀,故B错误;
C、滴加硝酸酸化的Ba(NO3)溶液有白色沉淀,如果原溶液中含有亚硫酸根离子,加入硝酸会把亚硫酸根离子氧化为硫酸根离子,和钡离子结合为白色沉淀硫酸钡,故C错误;
D、滴加BaCl2有白色沉淀,不一定含硫酸根,如果原溶液含有银离子,可以生成白色沉淀,如果含碳酸根也可以生成白色沉淀,故D错误;
故选A.
点评 本题考查了硫酸根离子的检验,重点考查干扰离对子硫酸根检验的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.用上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |
10. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是3.5×10-3mol•L-1;平衡时,NO的转化率为65%;
(2)已知该反应反应物的总能量大于生成物的总能量,则该反应是放热(填“放热”或“吸热”)反应.
(3)用O2表示从0-2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(4)如图中表示c(NO2)随时间的变化曲线是b.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)已知该反应反应物的总能量大于生成物的总能量,则该反应是放热(填“放热”或“吸热”)反应.
(3)用O2表示从0-2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(4)如图中表示c(NO2)随时间的变化曲线是b.
14.下列叙述正确的是( )
| A. | 新制氯水长期放置后会呈现浅黄绿色 | |
| B. | 长期放置的氯水也能使有色布条褪色 | |
| C. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| D. | 用氯气制漂白粉是为了得到易贮存的漂白剂 |
11.用NA表示阿德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6LO2与5.6LNO混合后的分子总数为0.5NA | |
| B. | 标准状况下,22.4升苯分子中含有6NA个C-Cσ键和6NAC-Hσ键 | |
| C. | 7.8克过氧化钠中含0.2NA阳离子和0.1NA阴离子 | |
| D. | 在500ml0.1mol•L-1NaAlO2溶液中AlO${\;}_{2}^{-}$数为5×10-2NA |
12.可与Ba(OH)2(固态)、CuSO4(固态)、纯CH3COOH三种物质归于一类的物质是( )
| A. | C2H5OH(水溶液) | B. | 盐酸 | C. | 水煤气 | D. | 烧碱 |
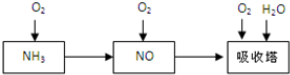
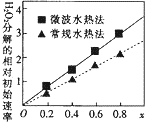 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极