题目内容
18.一定条件下,R${O}_{3}^{n-}$和氟气(F2)可发生如下反应:R${O}_{3}^{n-}$+F2+2OH-═R${O}_{4}^{-}$+2F-+H2O,从而可知在R${O}_{3}^{n-}$中,元素R的化合价是( )| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
分析 根据电荷守恒,得n=1,根据离子中各元素化合价代数和等于离子的所带电荷计算R${O}_{3}^{n-}$中R元素的化合价.
解答 解:根据电荷守恒可知,-n-2=-1-2,解得n=1.
令中R元素的化合价为a,离子中各元素化合价代数和等于离子的所带电荷,则:
a+(-2)×3=-1
解得:a=+5.
故选:B.
点评 本题考查氧化还原反应的计算,难度不大,也可以根据电子转移守恒计算,注意氧化还原反应计算中守恒思想的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列图式表示正确的是( )
| A. | 二氧化碳 | B. | 次氯酸的结构式 H-Cl-O | ||
| C. | 铝离子的结构示意图 | D. | 基态碳原子的价电子排布图为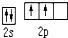 |
6.下列物质分类中,前者包含后者的是( )
| A. | 酸性氧化物 非金属氧化物 | B. | 溶液 胶体 | ||
| C. | 化合物 电解质 | D. | 有机物 分散系 |
13.常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应.用上述两种方法都可制得的氯化物是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |


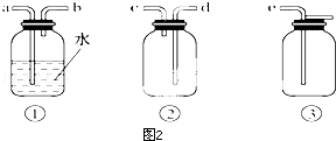

 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极