题目内容
17.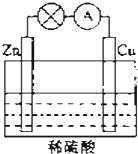 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
分析 根据锌比铜活泼,所以锌作负极,氢离子在正极Cu上得电子生成氢气,根据消耗的金属的量计算生成气体的量.
解答 解:由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
$\frac{65g}{6.5g}$=$\frac{2g}{Xg}$
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2.
点评 本题以原电池为载体考查了有关计算,明确各物理量之间的关系是解本题的关键,难度不大.

练习册系列答案
相关题目
7.甲烷在高温下可分解生成C2H2和H2.一定量的甲烷部分分解成C2H2和H2后,仍有CH4剩余,所得混合物的平均式量为12.8,则甲烷的分解率为( )
| A. | 10% | B. | 25% | C. | 50% | D. | 75% |
8.下列化合物中,不能由单质直接化合而得到的是( )
| A. | SiO2 | B. | HCl | C. | FeCl2 | D. | NO |
5.下列关于元素周期律的说法正确的是( )
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 非金属性:N<Si |
3.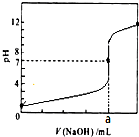 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )| A. | a=20.00 | |
| B. | 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 | |
| D. | 若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00 |
10.一氧化碳是一种用途十分广泛的化工基础原料.
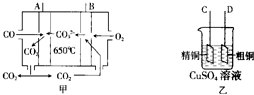
(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如表:
①某温度下,将2molCO(g)和6molH2(g)充入2L的密闭容器中,充分反应后,达到平衡时c(CO)=0.5mol/L,则CO(g)的转化率为50%,此时的温度为300°C.
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有DE(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为CO-2e-+CO32-=2CO2.
②进行粗铜精炼实验时,B极应该与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量小于(填“大于”“等于”或“小于”)6.4克.

(1)在高温下一氧化碳可将二氧化硫还原为单质硫.
乙知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
CO2(g)+C(s)=2CO(g)△H2=172.5kJ/mol
S(s)+O2(g)=SO2(g)△H3=-296.0kJ/mol
则CO还原SO2生成CO2(g)和S(s)的热化学方程为2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1.
(2)工业上一般采用CO与H2在一定条件下反应合成甲醇,反应为:CO(g)+2H2(g)?CH3OH(g).在不同温度下的化学平衡常数(K)如表:
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.250 | 0.012 |
②在恒容条件下,要提高CO(g)的转化率,呵以采取的措施有DE(填字母序号).
A.升高温度 B.加入催化剂 C.增加CO(g)的浓度D.充入H2(g)加压 E.分离出甲醇 F.充入稀有气体加压
③实际生产过程中,合成气要进行循环,其目的是提高原料利用率.
(3)如图图甲是一碳酸盐燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质;图乙是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
请问答下列问题:
①A极的电极反应式为CO-2e-+CO32-=2CO2.
②进行粗铜精炼实验时,B极应该与D极(填“C”或“D”)相连.
③当消耗2.24L(标准状况下)CO时,粗铜电极理论上减少铜的质量小于(填“大于”“等于”或“小于”)6.4克.
7.已知下表均为烷烃分子的化学式,且它们的一元取代物只有一种,问第五项烷烃化学式为( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
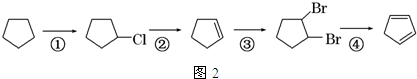
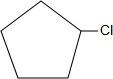 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$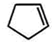 +NaCl+H2O;反应的化学方程式:
+NaCl+H2O;反应的化学方程式: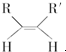 $\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式:
$\stackrel{O_{3}}{→}$$\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO,请写出下列反应产物的结构简式: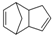 $\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O3}{→}$$\stackrel{H_{2}O/Zn}{→}$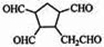 ;
; .
.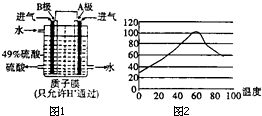 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;