题目内容
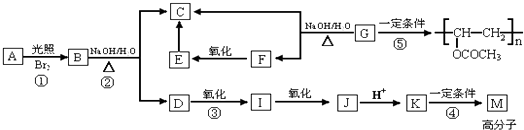
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)M在元素周期表中的位置_________________,写出Z的离子结构示意图___________。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式________________。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________。
(4)写出单质R的一种工业用途_______________________。
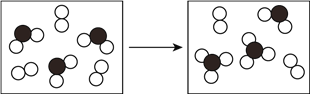
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。
(6)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,已知QX5中含有离子键和极性键,写出它的电子式______________。
【答案】 第3周期第ⅥA族 ![]()
![]() 2H2O2
2H2O2 ![]() 2H2O+O2↑ 制漂白粉,制漂白液,自来水消毒等合理答案 2SO2+O2
2H2O+O2↑ 制漂白粉,制漂白液,自来水消毒等合理答案 2SO2+O2 ![]() 2SO3 HSO-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O
2SO3 HSO-+ H2O + Cl2=SO42-+ 2Cl-+3H+ NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O 
【解析】试题分析:元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,则Y为O元素;M原子的最外层电子数与次外层电子数之比为3:4,则M为S元素;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,则X、Z、R分别为H、Na、Cl;Q和Y在周期表中的位置相邻,则Q为N元素。
(1)S元素在元素周期表中的位置第3周期第ⅥA族, Na+的离子结构示意图为![]() 。
。
(2)X、Y、R按原子个数之比1:1:1形成的化合物为次氯酸,其电子式为![]() 。
。
(3)X与Y可分别形成10电子的H2O和18电子的H2O2分子,该18电子分子转化成10电子分子的化学方程式为2H2O2 ![]() 2H2O+O2↑。
2H2O+O2↑。
(4)氯气的工业用途有:制漂白粉,制漂白液,自来水消毒等。
(5)由图中信息可知,两个3原子气体分子和1个双原子气体分子反应可以生成2个4原子分子,根据题中所涉及的元素,可以确定是二氧化硫和氧气反应生成三氧化硫,该转化过程的化学方程式为2SO2+O2 ![]() 2SO3。
2SO3。
(6)由H、O、Na、S四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,则A为亚硫酸氢钠,A与氯水反应的离子方程式HSO-+ H2O + Cl2=SO42-+ 2Cl-+3H+。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,则该反应的产物为氢气和氨水,该反应的化学方程式为NH5+H2O=H2↑+NH3·H2O或NH5+H2O=H2↑+NH3+H2O,已知NH5中含有离子键和极性键,则NH5为氢化铵,其电子式为![]() 。
。