题目内容
【题目】在1L2mol/L的AlCl3溶液中,加入1mol/L的NaOH溶液,产生了39g沉淀,则加入NaOH溶液的体积为 .
【答案】1.5L或7.5L
【解析】解:1L 2mol/L的AlCl3溶液中铝离子的物质的量=1L×2mol/L=2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=2mol×78g/mol=156g>39g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2 , n[Al(OH)3]= ![]() =0.5mol,①若碱不足,由Al3++3OH﹣═Al(OH)3↓可知,NaOH的物质的量为0.5mol×3=1.5mol,则V(NaOH)=
=0.5mol,①若碱不足,由Al3++3OH﹣═Al(OH)3↓可知,NaOH的物质的量为0.5mol×3=1.5mol,则V(NaOH)= ![]() =1.5L,②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2 , 则:
=1.5L,②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2 , 则:
Al3++ | 3 OH﹣═ | Al(OH)3↓ |
2mol | 6mol | 2mol |
溶解氢氧化铝的物质的量为2mol﹣0.5mol=1.5mol,
Al(OH)3+ | OH﹣═AlO2﹣+2H2O |
1.5mol | 1.5mol |
则消耗的碱的物质的量为6mol+1.5mol=7.5mol,则V(NaOH)= ![]() =7.5L,
=7.5L,
所以答案是:1.5L或7.5L.

【题目】为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究______条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________。
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____(填字母代号)。
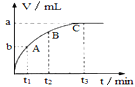
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察________________________,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________,所需仪器为_______。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________思想方法的应用。


