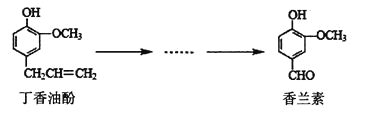
��Ŀ����
����Ŀ����Ԫ�����������õ�������ѧ���ʣ����㷺Ӧ�������������С����ú��ܷ���(��CoO��Co2O3������Al��Li��)��ȡCoCl2��6H2O������ͼ��ͼ��ʾ
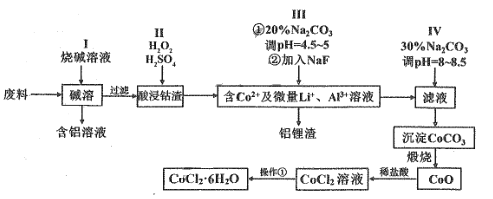
(1)д������I����Ҫ��Ӧ�Ļ�ѧ����ʽ_______��
(2)����II�п����������H2SO4��H2O2�Ļ��Һ����ȱ����___________��
(3)����III����Na2CO3��Һ��������__________��
(4)����ʵ�������� CaCO3����������β��ʵ��������ƾ��ƺͲ������⣬����______(����������)��
(5)�����ٵIJ�����______��________�����ˡ�ϴ�ӡ����ϴ�ӹ����п������Ҵ���ˮ�Ļ��Һ����ˮ���ŵ���_______��
(6)CoCl26H2O���������ֽ⣬ȡ119g�þ��������ijһ�¶ȣ��õ�CoCl2xH2O����83g����x=_____��
���𰸡�2Al+2NaOH+2H2O=2NaAlO2+3H2����2Li+2H2O=2LiOH+H2�� ��������Ϊ��������Ⱦ���� ����pH��ȥAl3+�� ������������ ����Ũ�� ��ȴ�ᾧ ���پ�����ܽ���ʧ 2
��������
���ܷ���(��CoO��Co2O3������Al��Li��)�����ռ���Һ�ܽ⣬�õ�������Һ�����˳�ȥ��Һ���õ����ܵ������������������ȡ�ܣ��õ�����Co2+��Al3+��Li+����Һ������̼������Һ����pH4.5��5����Al3+��2Al3++3CO32-+2H2O=2Al(OH)3��+3CO2�����ټ���NaF����Li+��֮����ˣ�����Һ�м�̼���Ƶ���pH��8��8.5������Co2+���õ�CoCO3������CoCO3�õ�CoO����ϡ�����ܽ�õ�CoCl2��Һ������Һ��HCl��Χ�У�����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�CoCl26H2O���Դ˽����⡣
(1)����IΪ���ܷ���(��CoO��Co2O3������Al��Li��)��NaOH��Һ��ϣ�Al��NaOH��Һ��Ӧ��Li��ˮ��Ӧ����Ӧ�ֱ�Ϊ��2Al+2NaOH+2H2O=2NaAlO2+3H2����2Li+2H2O=2LiOH+H2����
(2)������Ӧ���뻹ԭ������Co2O3��ԭΪCo2+������Ϊ��ԭ���ᣬ������������Ϊ�����������ж�����Ⱦ������
(3)�������Тټ���̼������Һ����pH4.5��5�ɳ�ȥAl3+��������Ӧ��2Al3++3CO32-+2H2O=2Al(OH)3��+3CO2����
(4)��ʵ��������CoCO3������Ĺ������������оƾ��ơ��������������������ǣ�
(5)�������Ǵ�CoCl2��Һ�нᾧCoCl26H2O������Ϊ������Һ��HCl��Χ�У�����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����ϴ�ӹ����п������Ҵ���ˮ�Ļ��Һ����ˮ�����Լ��پ�����ܽ���ʧ��
(6)119g�þ�������ʵ���Ϊ![]() =0.5mol����ˮ3mol�����Ⱥ�ʧȥ�ᾧˮ������Ϊ119g-83g=36g��n(H2O)=
=0.5mol����ˮ3mol�����Ⱥ�ʧȥ�ᾧˮ������Ϊ119g-83g=36g��n(H2O)=![]() =2mol����0.5molCoCl2xH2O��ˮΪ3mol-2mol=1mol������x=2��
=2mol����0.5molCoCl2xH2O��ˮΪ3mol-2mol=1mol������x=2��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�����Ŀ���Ȱ�����������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2C1��NHC12��NC13)����������������ˮ��������
�ش��������⣺
(1)��һ�Ȱ�(NH2Cl)�ĵ���ʽΪ__________��
�ڹ�ҵ�Ͽ����÷�ӦCl2(g)+NH3(g)=NH2Cl(l)+HCl(g)�Ʊ�һ�Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ�����費ͬ������ͬ�ֻ�ѧ����������ͬ������÷�Ӧ�ġ�H=______________��
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
��һ�Ȱ�����Ҫ��ˮ����������ԭ��������һ�Ȱ������ԡ����Ի����лᷢ��ˮ�⣬���ɾ���ǿ��ɱ�����õ����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
(2)��Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol C12��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NHCl2(g)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol C12��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (��������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ټ������У�0��40 min����NH3��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NH3)=______________��
�ڸ÷�Ӧ�ġ�H________0(�>����<��) ��������____________________��
�۶Ը÷�Ӧ������˵����ȷ����______________(��ѡ����ĸ����
A.�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B.��������C12��NH3���ʵ���֮�Ȳ��䣬�������Ӧ�ﵽƽ��״̬
C.��Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ����������Cl2��ת��������
D.��Ӧ�ﵽƽ��������������䣬����һ������NHCl2��ƽ�����淴Ӧ�����ƶ�
(3)�ں��������£�2molCl2��1molNH3������Ӧ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ƽ��ʱCl
NHCl2(l)+2HCl(g)�����ƽ��ʱCl

��A��B��C������Cl2ת������ߵ���______��(�A����B����C��)��
�ڼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=_______(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)
����Ŀ���й������ĸ����õ绯ѧװ�õ������У���ȷ���ǣ� ��
|
|
|
|
ͼ�����п�̵�� | ͼ��Ǧ-�������� | ͼ���⾫��ͭ | ͼ����пŦ�۵�� |
A.ͼ����ʾ����У�MnO2�������Ǵ���
B.ͼII��ʾ��طŵ�����У�����Ũ�Ȳ�������
C.ͼIII��ʾװ�ù��������У��������Һ��Cu2+Ũ��ʼ�ղ���
D.ͼIV��ʾ����У�Ag2O������������ع��������л�ԭΪAg