题目内容
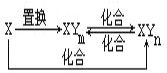
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1)途径Ⅰ还原剂与氧化剂物质的量之比为(不考虑杂质的反应)_____;碱浸时气体A的电子式为_______。
(2)途径II氧化时溶液中还有Na2SO4生成,则反应的离子方程式为____。
(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.40mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当CO32-的除去率为90%时,列式计算此时是否有BaMoO4沉淀生成____。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是_____。
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极的电极反应式为_____。
【答案】2:7 ![]() MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率为90%时,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀 Na2MoO4与杂质的溶解度受温度的影响不同 nMoS2+xLi++xe-=Lix(MoS2)n
MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率为90%时,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀 Na2MoO4与杂质的溶解度受温度的影响不同 nMoS2+xLi++xe-=Lix(MoS2)n
【解析】
(1)途径I MoS2与氧气反应生成MoO3和二氧化硫,Mo化合价由+2到+6升4,S化合价由-1到+4升5,1mol MoS2反应转移电子14mol,而氧气中氧元素由0价变为-2价,根据电子得失守恒可知还原剂MoS2与氧化剂O2物质的量之比为2:7;途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;碱浸时气体A(CO2)的电子式为![]() ;
;
(2)途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,离子反应方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)CO32-的去除率为90%时,溶液中c(CO32-)=0.04mol/L,则溶液中c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀;
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是Na2MoO4与杂质的溶解度受温度的影响不同;
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极MoS2得电子产生Lix(MoS2)n,电极反应式为nMoS2+xLi++xe-=Lix(MoS2)n。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案