题目内容
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2) Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为________(各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
(5)化合物甲由X、Z、M、W和Fe五种元素组成,甲的摩尔质量为392g·mol-1, 1 mol甲中含有6 mol结晶水。对化合物甲进行如下实验:
a.取甲的水溶液少许,加入过量的浓NaOH溶液,加热,产生白色絮状沉淀和无色、有刺激性气味的气体;白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
b.另取甲的水溶液少许,加入过量的BaCl2溶液,产生白色沉淀;再加盐酸,白色沉淀不溶解。
① 甲的化学式为________。
② 已知100 mL 1 mol·L-1的甲溶液能与20 mL 1 mol·L-1的酸性KMnO4溶液恰好反应,写出反应的离子方程式:____________。
【答案】 第二周期IVA族 S2- N≡N 0.045mol/L(或1/22.4mol/L) HNO3(或HNO2)、NH3·H2O、NH4NO3(或NH4NO2) C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O (NH4)2Fe(SO4)2·6H2O 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
CO2↑+2SO2↑+2H2O (NH4)2Fe(SO4)2·6H2O 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
【解析】原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,在周期表中X是原子半径最小的元素,则X为H元素;元素Y原子的最外层电子数是其电子层数的2倍,Y为C或S,结合原子序数可知,Y不可能为S元素,故Y为C元素;Z、M左右相邻,M、W位于同主族,令Z的原子序数为a,可知M原子序数为a+1,W原子序数为a+9,X、Z、M、W四种元素的原子序数之和为32,则1+a+a+1+a+9=32,解得a=7,故Z为N元素、M为O元素、W为S元素。
(1) Y为C元素,在周期表中位于第二周期IVA族,W为S元素,W的阴离子符号是S2-,故答案为:第二周期IVA族;S2-;
(2)Z为N元素,单质的结构式为N≡N;标况下,Z的氢化物为氨气,氨气极易溶于水,试管中收集满氨气,倒立于水中(溶质不扩散),一段时间后,氨气体积等于溶液的体积,令体积为1L,则试管内溶液的物质的量浓度为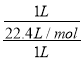 =0.045mol/L,故答案为:N≡N;0.045mol/L;
=0.045mol/L,故答案为:N≡N;0.045mol/L;
(3)X为H元素、Z为N元素、M为O元素。由H、N、O三种元素组成的化合物是酸、碱、盐的化学式分别为HNO3(或HNO2)、NH3·H2O、NH4NO3(或NH4NO2),故答案为:HNO3(或HNO2)、NH3·H2O、NH4NO3(或NH4NO2);
(4)加热时,碳与浓硫酸发生反应的化学方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(5)①取甲的溶液加入过量的浓NaOH溶液并加热,产生白色絮状沉淀和无色刺激性气味气体,过一段时间白色絮状沉淀变为灰绿色,最终变为红褐色,则说明甲中有亚铁离子和铵根离子,另取甲的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,则说明甲中有硫酸根离子,1mol甲中含有6mol结晶水,即甲的化学式中含有6个结晶水,甲的摩尔质量为392g/mol,则甲的化学式为(NH4)2Fe(SO4)26H2O,故答案为:(NH4)2Fe(SO4)2·6H2O;
②100 mL 1 mol·L-1的甲溶液中含有0.1mol Fe2+,20 mL 1 mol·L-1的酸性KMnO4溶液中含有0.02mol MnO4-,恰好反应生成铁离子和锰离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。


