题目内容
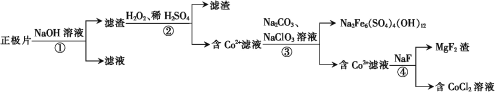
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
【答案】C
【解析】
废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等),将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCoO2、Al及少量铁、镁的化合物;将滤渣用双氧水、硫酸处理后生成硫酸镁、CoSO4、Fe2(SO4)3,锂在滤渣中被除掉,再通过③除掉Fe3+,再通过④除掉镁元素,最后得CoCl2溶液。
A、①中反应是氢氧化钠和铝反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A正确;
B、②中H2O2作将正三价Co还原为Co2+,H2O2作还原剂,故B正确;
C、③中Na2CO3如果用NaOH代替,则会生成氢氧化铁、氢氧化钴沉淀,降低了Co2+的回收率,故C错误;
D、④中除镁反应如果在强酸条件下进行,则NaF会生成有毒气体HF污染环境,且降低F-的浓度,影响镁的去除,故D正确。
答案选C。

练习册系列答案
相关题目