题目内容
【题目】元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m≠n,且均为正整数).下列说法正确的是( )
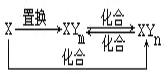
A. X一定是金属元素
B. (n-m)一定等于1
C. 由X生成1molXYm时转移的电子数目一定为4NA
D. 三个化合反应一定都是氧化还原反应
【答案】D
【解析】A项,由产物组成可知X有多种价态,当X是铁时,Y可以氯元素等,可以发生如下反应:Fe+2HCl=FeCl2+H2↑、2FeCl2+Cl2=2FeCl3、2Fe+3Cl2![]() 2FeCl3、2FeCl3+Fe=3FeCl2,满足此框图;当X是碳时,Y可以是氧元素,存在反应:C+H2O
2FeCl3、2FeCl3+Fe=3FeCl2,满足此框图;当X是碳时,Y可以是氧元素,存在反应:C+H2O![]() CO+H2、C+O2
CO+H2、C+O2![]() CO2、2CO+O2
CO2、2CO+O2![]() 2CO2、CO2+C
2CO2、CO2+C![]() 2CO,也满足此框图,故A错误;B项,若X为碳,XYm是CO2,XYn为CO时,符合转化关系,则(n-m)≠1,故B错误;C项,若X为Fe,与盐酸反应生成XYm为FeCl2,XYn是FeCl3时,符合转化关系,生成1mol FeCl2时转移电子为2mol,故C错误;D项,有单质参加的化合反应属于氧化还原反应,置换反应都属于氧化还原反应,XYm与XYn中X元素的化合价不同,二者之间的反应也属于氧化还原反应,故D正确。此题答案选D。
2CO,也满足此框图,故A错误;B项,若X为碳,XYm是CO2,XYn为CO时,符合转化关系,则(n-m)≠1,故B错误;C项,若X为Fe,与盐酸反应生成XYm为FeCl2,XYn是FeCl3时,符合转化关系,生成1mol FeCl2时转移电子为2mol,故C错误;D项,有单质参加的化合反应属于氧化还原反应,置换反应都属于氧化还原反应,XYm与XYn中X元素的化合价不同,二者之间的反应也属于氧化还原反应,故D正确。此题答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是____________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol·L-1。写出该混合溶液中的下列算式的精确结果 (数据不能做近似计算,不用化简)。c(Na+)-c(A-)=____________mol·L-1 c(OH-)-c(HA)=____________mol·L-1
