题目内容
【题目】已知:CH4(g)+2H2S(g) ![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
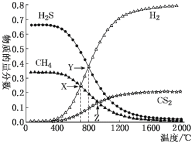
下列说法正确的是
A.该反应的ΔH<0
B.X点与Y点容器内压强比为55∶51
C.X点CH4的转化率为20%
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1 mol 时υ(正)<υ(逆)
【答案】CD
【解析】
A. 由图可知升温平衡右移,所以该反应的ΔH>0,选项A错误;
B. X点CH4和H2的物质的量分数相等,根据反应CH4(g)+2H2S(g)![]() CS2(g)+4H2(g),4n(CH4)转化=0.1mol-n(CH4)转化,解得n(CH4)转化=0.02mol,X点容器内气体物质的量为(0.3+2×0.02)mol=0.34mol,Y点H2S和H2的物质的量分数相等,根据反应CH4(g)+2H2S(g)
CS2(g)+4H2(g),4n(CH4)转化=0.1mol-n(CH4)转化,解得n(CH4)转化=0.02mol,X点容器内气体物质的量为(0.3+2×0.02)mol=0.34mol,Y点H2S和H2的物质的量分数相等,根据反应CH4(g)+2H2S(g)![]() CS2(g)+4H2(g),2n(H2S)转化=0.2mol-n(H2S)转化,解得n(H2S)转化=
CS2(g)+4H2(g),2n(H2S)转化=0.2mol-n(H2S)转化,解得n(H2S)转化=![]() mol,Y点气体物质的量为
mol,Y点气体物质的量为![]() mol,X点与Y点物质的量之比为0.34mol:
mol,X点与Y点物质的量之比为0.34mol:![]() mol=51:55,若温度相同,X点与Y点压强之比为51:55,但X点温度低于Y点,X点与Y点压强之比小于51:55,选项B错误;
mol=51:55,若温度相同,X点与Y点压强之比为51:55,但X点温度低于Y点,X点与Y点压强之比小于51:55,选项B错误;
C. X点CH4和H2的物质的量分数相等,根据反应CH4(g)+2H2S(g)![]() CS2(g)+4H2(g),4n(CH4)转化=0.1mol-n(CH4)转化,解得n(CH4)转化=0.02mol,所以X点CH4的转化率为
CS2(g)+4H2(g),4n(CH4)转化=0.1mol-n(CH4)转化,解得n(CH4)转化=0.02mol,所以X点CH4的转化率为![]() ×100%=20%,选项C正确;
×100%=20%,选项C正确;
D. 设容器体积为V,Z点CH4与CS2物质的量分数相等,n(CH4)转化=0.1mol-n(CH4)转化,解得n(CH4)转化=0.05mol,Z点平衡时n(CH4)=n(CS2)=0.05mol、n(H2)=0.2mol、n(H2S)=0.1mol,平衡常数K=![]() =
=![]() ,向容器中再充入CH4、H2S、CS2、H2各0.1 mol时,n(CH4)=n(CS2)=0.15mol、n(H2)=0.3mol、n(H2S)=0.2mol,浓度商Qc=
,向容器中再充入CH4、H2S、CS2、H2各0.1 mol时,n(CH4)=n(CS2)=0.15mol、n(H2)=0.3mol、n(H2S)=0.2mol,浓度商Qc=![]() =
=![]() >K,所以反应逆向进行,υ(正)<υ(逆),选项D正确。
>K,所以反应逆向进行,υ(正)<υ(逆),选项D正确。
答案选CD。