题目内容
【题目】实验室需要0.80 mol·L-1 NaOH溶液475 mL 和0.40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是____________________(填仪器名称)。
(2)容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.贮存溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为___________g。
(4)在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度________0.80 mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度________0.80 mol·L-1。
(5)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,最好选用________mL的量筒。
【答案】
【解析】
:(1)配制溶液用不到圆底烧瓶和分液漏斗。
(2)容量瓶只能用于配制一定体积准确浓度的溶液,也可以量取与容量瓶的规格相一致的一定体积的液体,但不能测量容量瓶规格以下的任意体积的液体,不能用于溶解溶质或贮存溶液。
(3)必须用500 mL的容量瓶来配制0.80 mol·L-1NaOH溶液,故需要称取NaOH的质量为0.80 mol·L-1×0.5 L×40 g·mol-1=16.0 g。容量瓶未干燥不影响所配制溶液的浓度;未等溶液冷却就定容会导致冷却后溶液的体积变小,浓度变大。
(4)设需要浓硫酸的体积为V,1.84 g·cm-3×V×98%=0.40 mol·L-1×0.5 L×98 g·mol-1,V≈10.9 mL,应选用15 mL的量筒。
答案:(1)A、C 烧杯、玻璃棒 (2)C、D、E (3)16.0 等于 大于 (4)10.9 15

【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
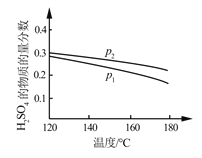
p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。