题目内容
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
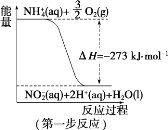

①第一步反应是_________________(填“放热”或“吸热”)反应,判断依据是___________。
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是_________________。
(2)已知红磷比白磷稳定,则反应 P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1;4P(红磷,s)+ 5O2(g)===2P2O5(s)ΔH2;ΔH1 和 ΔH2 的关系是 ΔH1____________ΔH2(填“>”、“<”或“=”)。
(3)在 298 K、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g) ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则 ΔH3 与 ΔH1 和 ΔH2 之间的关系正确的是___________。
A ΔH3=ΔH1+2 ΔH2 B ΔH3=ΔH1+ΔH2
C ΔH3=ΔH1-2ΔH2 D ΔH3=ΔH1-ΔH2
(4)已知 H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发 1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol 分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中 a=__________________。
【答案】放热 ΔH<0(或反应物的总能量大于生成物的总能量) ![]() (aq)+2O2(g)===NO
(aq)+2O2(g)===NO![]() (aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 < A 369
(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 < A 369
【解析】
(1)①有图可知:焓变小于0,即反应物的总能量大于生成物的总能量,所以该反应为放热反应,故答案为:放热,ΔH<0(或反应物的总能量大于生成物的总能量)。
②第一步的热化学方程式为①NH4+(aq)+1.5O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH=-273kJ/mol,第二步的热化学方程式为②NO2-(aq) +0.5O2(g)=NO3-(aq) ΔH=-73kJ/mol,根据盖斯定律,由①+②可得:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq) ΔH=(-273kJ/mol)+(-73kJ/mol)=-346kJ·mol-1,故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。
(2)①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2,由盖斯定律②-①可得到反应:4P(红磷,s)=P4(白磷,s) ΔH=ΔH2-ΔH1,红磷比白磷稳定,说明红磷的能量低于白磷,该反应是吸热反应,即ΔH=ΔH2-ΔH1>0,即ΔH1<ΔH2,故答案为:<。
(3)已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则反应③=②×2+①,由盖斯定律可知:ΔH3=ΔH1+2ΔH2,故选A,故答案为:A。
(4)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,则H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,ΔH=反应物键能-生成物键能,则有-102=436+200-2a,解得a=369,故答案为:369。