题目内容
13.写出下列反应的化学方程式:①溴乙烷在氢氧化钠的醇溶液中共热CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O
②乙酸乙酯在氢氧化钠的水溶液中共热CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH.
分析 ①溴乙烷在氢氧化钠的醇溶液中共热,发生消去反应生成乙烯;
②乙酸乙酯在热的氢氧化钠溶液水解生成乙酸钠和乙醇.
解答 解:①卤代烃在氢氧化钠的醇溶液中发生消去反应,溴乙烷与氢氧化钠的乙醇溶液反应生成乙烯,反应的化学方程式为CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O;
②乙酸乙酯在热的氢氧化钠溶液水解生成乙酸钠和乙醇,化学方程式为CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH,故答案为:CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握官能团和性质的关系及有机反应,注意相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.无机化合物可根据其组成和性质进行如下分类:
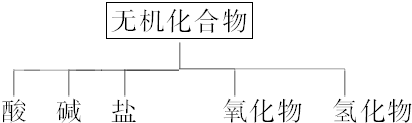
(1)
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表②③⑥的后面.
(2)写出⑦转化为⑤的化学方程式:Na2O+CO2═Na2CO3.
(3)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,.
(4)实验室制备⑦常用石灰石(或大理石)和稀盐酸反应,检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是CO2.

(1)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2S、HNO3、H2CO3、H2SO4 | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2CO3、Na2SO4、K2CO3、K2SO4、NaNO3、KNO3 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(2)写出⑦转化为⑤的化学方程式:Na2O+CO2═Na2CO3.
(3)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,.
(4)实验室制备⑦常用石灰石(或大理石)和稀盐酸反应,检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是CO2.
4.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸(HClO2为弱酸)不稳定可分解,反应的离子方程式为:
5HClO2=4ClO2↑+H++Cl-+2H2O.向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
5HClO2=4ClO2↑+H++Cl-+2H2O.向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
| A. | 在酸性条件下,亚氯酸钠的氧化性增强 | |
| B. | 溶液中的Cl-起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 溶液中的H+起催化作用 |
1.前四周期元素X、Y、Z、W,已知W2+、Y+、X2-、Z-的离子具有相同的电子层结构.下列说法正确的是( )
| A. | 电负性:X>Y>Z>W | B. | 电离能:X>Y>Z>W | ||
| C. | 离子半径:X2->Z->Y+>W2+ | D. | 原子序数:W>Y>X>Z |
8.同温同压下,在体积均为V L的密闭容器中分别装有CO2和CO,下列说法正确的是( )
| A. | 质量之比44:30 | B. | 分子数之比2:1 | C. | 原子数之比1:1 | D. | 密度之比11:7 |
18.下列叙述中正确的是( )
| A. | 加热铝片出现的“悬而不滴”,是由于铝的熔点比氧化铝高 | |
| B. | 得电子越多的氧化剂,其氧化性不一定越强 | |
| C. | 某元素从化合态变成游离态,该元素一定被还原 | |
| D. | FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
3.NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |