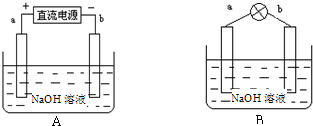
题目内容
12.实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如下实验,制取并探究SO2的性质.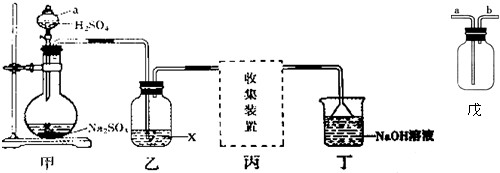
(制取SO2反应原理为:Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O)
【探究实验】(1)甲装置中a仪器的名称是分液漏斗.
(2)实验中若生成若生成标准状况下1.12LSO2,则需要Na2SO36.3g参加反应.
(已知:Na2SO3的摩尔质量为126g•mol-1)
(3)①若X是品红溶液,气体通过乙装置,观察到的现象是品红溶液褪色;
②若X是酸性KMnO4溶液,气体通过乙装置,观察到溶液褪色,说明SO2具有B.
A.酸性 B.还原性 C.漂白性
(4)丁装置中NaOH溶液的作用是吸收多余的SO2,请将其中反应的化学方程式补充完整:
SO2+NaOH═Na2SO3+H2O
【实验讨论】(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,
A、B两位同学的连接方式为:
A同学:SO2气体从a导管通入集气瓶中.
B同学:SO2气体从b导管通入集气瓶中.
正确的收集装置是A(填“A”或“B”)同学的连接方式.
(已知:同等条件下SO2的密度大于空气)
【知识应用】
(6)向盛有水的烧杯中通入SO2,所得溶液的pH<(填“>”或“=”或“<”)7.SO2是形成酸雨的主要物质,请你提出一种减少SO2对空气污染的可行措施:减少化石燃料的使用(或对SO2的排放加以控制,改善能源结构、开发利用清洁能源,工业上对煤进行脱硫处理,对SO2气体进行处理货回收利用).
分析 (1)根据仪器的构造可知a为分液漏斗;
(2)根据n=$\frac{V}{{V}_{m}}$计算出二氧化硫的物质的量,再根据反应方程式计算出亚硫酸钠的物质的量,最后根据m=nM计算出亚硫酸钠的质量;
(3)①根据二氧化硫具有漂白性分析实验现象;
②酸性高锰酸钾具有强氧化性,能够将二氧化硫氧化,体现了二氧化硫的还原性;
(4)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应生成亚硫酸钠和和水,根据质量守恒配平该反应方程式;
(5)二氧化硫的密度大于空气,需要导管需要采用长进短处的方法;
(6)二氧化硫溶于水生成亚硫酸,亚硫酸为弱酸,所以所得溶液的pH小于7;从二氧化硫的来源分析治理措施.
解答 解:(1)根据图示可知,装置甲中仪器a的名称为分液漏斗,故答案为:分液漏斗;
(2)标准状况下1.12LSO2的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,根据反应Na2SO3+2H2SO4═Na2SO4+SO2↑+H2O可知,生成0.05mol二氧化硫需要消耗0.05mol亚硫酸钠,其质量为:126g/mol×0.05mol=6.3g,
故答案为:6.3;
(3)①若X为品红溶液,二氧化硫具有漂白性,生成的二氧化硫气体能够使品红溶液褪色,
故答案为:品红溶液褪色;
②若X是酸性KMnO4溶液,酸性高锰酸钾溶液具有强氧化性,当气体通过乙装置时酸性高锰酸钾溶液褪色,说明SO2被氧化,二氧化硫表现出了还原性,
故答案为:B;
(4)二氧化硫有毒,为酸性氧化物,多余的二氧化硫需要用碱液吸收,二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:1;2;1;1;Na2SO3;
(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,由于二氧化硫的密度大于空气,则进入集气瓶的导管应该长,即:SO2气体从a导管通入集气瓶中,故选A,
故答案为:A;
(6)二氧化硫为酸性氧化物,向盛有水的烧杯中通入SO2,二氧化硫与水反应生成亚硫酸,亚硫酸部分电离出氢离子,则所得溶液的pH<7;
SO2是形成酸雨的主要物质,需要采取措施减少SO2对空气污染,方法如:①减少化石燃料的使用;②对SO2的排放加以控制;③改善能源结构、开发利用清洁能源;④工业上对煤进行脱硫处理;⑤对SO2气体进行处理货回收利用,
故答案为:<;减少化石燃料的使用(或对SO2的排放加以控制,改善能源结构、开发利用清洁能源,工业上对煤进行脱硫处理,对SO2气体进行处理货回收利用).
点评 本题考查了二氧化硫的制备方法及性质,题目难度中等,明确二氧化硫的制备原理及化学性质为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | S2-+2H+═H2S↑ | B. | 2Fe3++Fe═3Fe2+ | ||
| C. | NH4Cl+NaOH═NH3•H2O+NaCl | D. | Ca(ClO)2+CO2+H2O═CaCO3+2HClO |
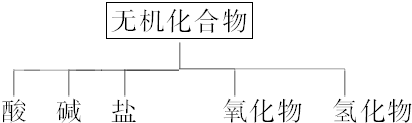
(1)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2S、HNO3、H2CO3、H2SO4 | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2CO3、Na2SO4、K2CO3、K2SO4、NaNO3、KNO3 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(2)写出⑦转化为⑤的化学方程式:Na2O+CO2═Na2CO3.
(3)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,.
(4)实验室制备⑦常用石灰石(或大理石)和稀盐酸反应,检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是CO2.
| A. | 氢氧化钠溶液与稀硝酸反应:OH-+H+═H2O | |
| B. | 溴化钾溶液中通入氯气:Br-+Cl2═Br2+Cl- | |
| C. | 稀盐酸与碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| D. | 铁粉与稀硫酸反应:Fe+H+═Fe3++H2↑ |
5HClO2=4ClO2↑+H++Cl-+2H2O.向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
| A. | 在酸性条件下,亚氯酸钠的氧化性增强 | |
| B. | 溶液中的Cl-起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 溶液中的H+起催化作用 |
| A. | 电负性:X>Y>Z>W | B. | 电离能:X>Y>Z>W | ||
| C. | 离子半径:X2->Z->Y+>W2+ | D. | 原子序数:W>Y>X>Z |