题目内容
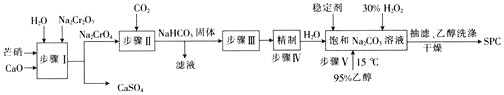
【题目】SPC(2Na2CO33H2O2)具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO410H2O)、H2O2等为原料制备SPC的工艺流程如下:
回答下列问题:
⑴步骤Ⅰ中________![]() 填“有”或“没有”
填“有”或“没有”![]() 发生氧化还原反应。
发生氧化还原反应。
⑵步骤Ⅱ中会生成一种可以循环使用的物质,该物质的化学式为________。
⑶步骤Ⅲ中需要加热,发生反应的化学方程式为_________________________________。
⑷步骤Ⅴ中,合成时需选择温度为15℃,其目的是___________。
⑸SPC的保存方法是_____________________________。
⑹过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600g样品,置于250mL锥形瓶中,并用100mL 0.5 mol·L-1硫酸溶解完全,立即用0.02000mol·L-1 KMnO4标准溶液滴定,滴定至终点时溶液颜色为________,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24mL。该样品的活性氧含量为_______%。
【答案】没有 Na2Cr2O7 2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O 当温度低于15℃,反应速率减小;温度高于15℃时,过氧化氢受热分解 低温、避光、密封保存 浅红色 12.16
Na2CO3 + CO2↑+ H2O 当温度低于15℃,反应速率减小;温度高于15℃时,过氧化氢受热分解 低温、避光、密封保存 浅红色 12.16
【解析】
⑴据反应前后元素的化合价变化进行分析;
⑵滤液中的主要成分在流程中可以循环使用,根据分析可得滤液中含有铬元素,且CrO42-转化为Cr2O72-得出;
⑶步骤Ⅱ中生成的碳酸氢钠溶解度较小,加热发生分解反应;
⑷当温度低于15℃,反应速率减小;温度高于15℃时,过氧化氢受热分解;
⑸由于双氧水易分解,所以SPC应低温、避光、密封保存;
⑹根据反应方程式和比例关系建立关系式计算。
⑴反应前后元素的化合价未发生变化,故没有发生氧化还原反应;故答案为:没有;
⑵滤液中的主要成分在流程中可以循环使用,根据分析可得滤液中含有铬元素,且CrO42-+ 2H+ ![]() Cr2O72-+ H2O,则该循环物质一定是Na2Cr2O7;故答案为:Na2Cr2O7;
Cr2O72-+ H2O,则该循环物质一定是Na2Cr2O7;故答案为:Na2Cr2O7;
⑶步骤Ⅱ中生成的碳酸氢钠溶解度较小,加热分解发生反应:2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O;故答案为:2NaHCO3
Na2CO3 + CO2↑+ H2O;故答案为:2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O;
Na2CO3 + CO2↑+ H2O;
⑷步骤Ⅴ中,合成时需选择温度为15℃,其目的是当温度低于15℃,反应速率减小;温度高于15℃时,过氧化氢受热分解;故答案为:当温度低于15℃,反应速率减小;温度高于15℃时,过氧化氢受热分解;
⑸由于双氧水易分解,所以SPC应低温、避光、密封保存;故答案为:低温、避光、密封保存;
⑹滴定至终点时,KMnO4溶液稍过量,溶液呈浅红色;根据得失电子守恒配平写出离子方程式:6H+ + 2MnO4-+ 5H2O2 = 8H2O + 2Mn2+ + 5O2↑,三次滴定平均消耗KMnO4溶液26.56 mL,空白实验消耗KMnO4溶液的平均体积为2.24mL,再依据关系式:
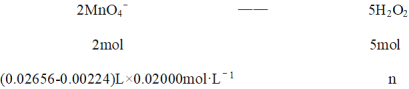
2mol: (0.02656-0.00224)L×0.02000mol·L-1 = 5mol:n
解得n = 0.001216mol,SPC产品中活性氧含量![]() ,故答案为:12.16%。
,故答案为:12.16%。

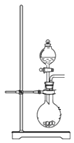
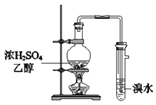
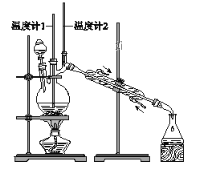
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
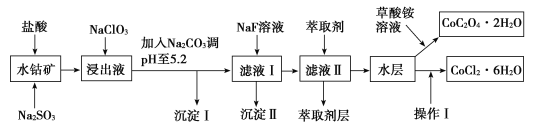
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
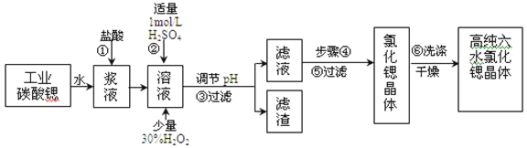
已知:I.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
II.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
⑴在步骤②中加入少量的30% H2O2,反应的离子方程式_______________。
⑵在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为__________。过滤所得滤渣的主要成分是_______________。
⑶关于上述流程中的步骤④、⑤、⑥的说法,正确的是____________。
A. 步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B. 可以通过降低结晶速率的方法来得到较大颗粒的SrCl26H2O晶体
C. 某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D. 步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和![]() 溶液
溶液
⑷工业上采用减压烘干或者用50~60℃的热风吹干SrCl26H2O晶体的原因是______________。
⑸为了测定所得SrCl26H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的硝酸银溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl26H2O晶体样品的纯度。用去上述浓度的NH4SCN溶液20.00mL,则原SrCl26H2O晶体的纯度为_____________________。