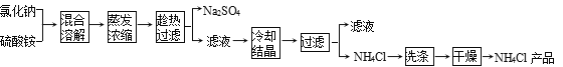
��Ŀ����
����Ŀ����ͼ��ʾ����ʵ��װ�ã��ֱ�ش��������⡣
ͼ1ͼ2ͼ3
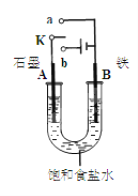
��1��ͼ1�У��� ����ʼʱ����K��a���ӣ����װ��Ϊ_____����װ�����ƣ����缫A�ĵ缫��ӦʽΪ________________________
������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ___________________________
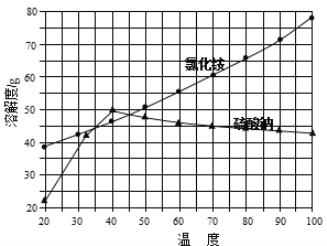
��2��2004������ʥ·��˹��ѧ������һ�����͵��Ҵ���أ����û����������ܼ�����200��C����ʱ���磬���ʾ����ͼ2��ʾ��
��______������a��b��Ϊ��ص���������ع���ʱ��������Ϊ_________����a��b��b��a��
��д���õ�ظ����ĵ缫��Ӧʽ________________________________________
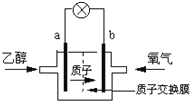
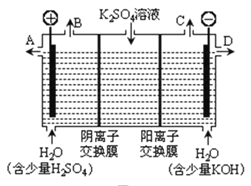
��3����ͼ3װ�õ���������Һ����ȡ������������������������أ������ڵ������ӽ���Ĥֻ����������ͨ���������ӽ���Ĥֻ����������ͨ������
�ٸõ��۵�������ӦʽΪ_____________________��
���Ƶõ�������Һ�ӳ���____���A������D��������,������ԭ��__________________________(���û�ѧ��������ֽ���)
���𰸡� ԭ��� 2H2O��O2��4e����4OH�� 2H2O��2Cl-![]() 2OH����H2����Cl2�� b b��a C2H5OH-12e��+3H2O��12H++2CO2 2H2O��2e����2OH����H2�� ��2H+��2e����H2�� A 2H2O-4e����4H+��O2��,OH���������ŵ磬ʹˮ�ĵ���ƽ�������ƶ��� c(H+)����SO42-ͨ�������ӽ���Ĥ������������H+��ϳ�����
2OH����H2����Cl2�� b b��a C2H5OH-12e��+3H2O��12H++2CO2 2H2O��2e����2OH����H2�� ��2H+��2e����H2�� A 2H2O-4e����4H+��O2��,OH���������ŵ磬ʹˮ�ĵ���ƽ�������ƶ��� c(H+)����SO42-ͨ�������ӽ���Ĥ������������H+��ϳ�����
�����������⿼��绯ѧ����1��ͼ1�У�����K��a�����γ�ԭ��ط�Ӧ������������ʴ��A�缫ʯī��������Һ�������õ������������������ӣ��缫��ӦΪ��O2+2H2O+4e��=4OH�����ڿ���K��b���ӣ�װ��Ϊ���أ�ʯī����������Ϊ�������൱�ڵ�ⱥ��ʳ��ˮ�����������ơ�����������������ܷ�Ӧ�����ӷ���ʽΪ2Cl��+2H2O![]() 2OH��+H2��+Cl2������2����ȼ�ϵ���У�ȼ���Ҵ��ڸ���(a��)����ʧ���ӵķ�Ӧ��������������(b��)�Ϸ����õ��ӵķ�Ӧ�������ڵ�·�д�������������b��a���ڸõ�ظ����ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��=2CO2+12H+����3���ٵ��ʱ�������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H++2e��=H2����2H2O��2e����2OH����H2������������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2����OH���������ŵ磬�������������������ƶ����õ缫�ϻ�������ᣬ���������ӷŵ磬��˼������������ƶ����������������������������ɣ���������������Һ�ӳ���D�������Ƶõ�������Һ��A��������
2OH��+H2��+Cl2������2����ȼ�ϵ���У�ȼ���Ҵ��ڸ���(a��)����ʧ���ӵķ�Ӧ��������������(b��)�Ϸ����õ��ӵķ�Ӧ�������ڵ�·�д�������������b��a���ڸõ�ظ����ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��=2CO2+12H+����3���ٵ��ʱ�������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��2H++2e��=H2����2H2O��2e����2OH����H2������������ʧ���ӷ���������Ӧ����Һ�е����������ӵķŵ�����������������ӵķŵ���������������������������ʧ��������ˮ������4OH����4e��=2H2O+O2����OH���������ŵ磬�������������������ƶ����õ缫�ϻ�������ᣬ���������ӷŵ磬��˼������������ƶ����������������������������ɣ���������������Һ�ӳ���D�������Ƶõ�������Һ��A��������

 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�