题目内容
【题目】用铁屑为原料制备三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3])的化学方程式依次为:
①Fe(s)+H2SO4=FeSO4+H2↑
②FeSO4+H2C2O4+2H2O = FeC2O4·2H2O↓+H2SO4
③2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
已知: K3[Fe(C2O4)3]·3H2O 易溶于水, 难溶于乙醇。
回答下列问题:
(1)在反应①得到的 FeSO4溶液中, 需加入少量 H2SO4酸化, 目的是_________。
(2)为从反应③后的溶液得到 K3[Fe(C2O4)3]晶体, 某同学设计的实验步骤为: “加热蒸发—冷却结晶 —抽滤—洗涤 —干燥 ”,请评价该方案的合理性,并说明理由____________。
(3)为从反应③后的溶液中得到 K3[Fe(C2O4)3]·3H2O 晶体,请再设计另外一种实验方案(不要求写具体的实验操作)_______________。
(4)过滤K3[Fe(C2O4)3]·3H2O晶体有关的操作正确的是_______。
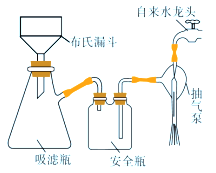
A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
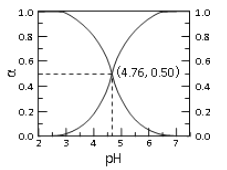
(5)称取 5.00g 制得的晶体加水溶解,配成 250mL 溶液,取 25.00mL 于锥形瓶中,用0.100mol·L-1 酸性高锰酸钾标准溶液滴定,重复三次实验,平均消耗 12.00mL。 计算所得的样品中K3[Fe(C2O4)3]·3H2O的纯度为________。
【答案】 Fe2+的水解 不合理,因为加热蒸发会导致 H2O2 分解、 Fe3+的水解、 得到的晶体不纯等 向溶液中“加入适量乙醇—过滤—洗涤—干燥”得晶体 A D 98.2%
【解析】(1)在反应①得到的 FeSO4溶液中, 需加入少量 H2SO4酸化, 目的是抑制Fe2+的水解。
(2)为从反应③后的溶液得到 K3[Fe(C2O4)3]晶体, 某同学设计的实验步骤为: “加热蒸发—冷却结晶 —抽滤—洗涤 —干燥 ”,该方案不合理,因为加热蒸发会导致 H2O2 分解、 Fe3+的水解、 得到的晶体不纯等。
(3)为从反应③后的溶液中得到 K3[Fe(C2O4)3]·3H2O 晶体,由题中信息知,K3[Fe(C2O4)3]·3H2O 易溶于水,难溶于乙醇,设计如下实验方案:向溶液中“加入适量乙醇—过滤—洗涤—干燥”得晶体。
(4)过滤K3[Fe(C2O4)3]·3H2O晶体有关的操作:A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸,A正确;B.放入滤纸后,要滴加蒸馏水使滤纸紧贴于漏斗,打开水龙头,将混合物摇匀后缓慢转移至漏斗中抽滤,B不正确;C.洗涤晶体时,不要关闭水龙头,用蒸馏水缓慢淋洗,抽滤后关闭水龙头,C不正确;D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸,D正确。综上所述,正确的是A D。
(5)称取 5.00g 制得的晶体加水溶解,配成 250mL 溶液,取 25.00mL于锥形瓶中,用0.100mol·L-1 酸性高锰酸钾标准溶液滴定,重复三次实验,平均消耗 12.00mL。 根据电子转移守恒可得关系式5K3[Fe(C2O4)3]·3H2O ~ 6KMnO4,n(K3[Fe(C2O4)3]·3H2O)= ![]() n(KMnO4)=
n(KMnO4)= ![]() 0.100mol·L-1 =0.00100mol,所得的样品中K3[Fe(C2O4)3]·3H2O的纯度为
0.100mol·L-1 =0.00100mol,所得的样品中K3[Fe(C2O4)3]·3H2O的纯度为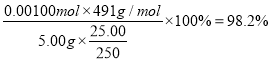 。
。

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:________。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:_______________________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |