题目内容
19.甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y是化合物.X溶液呈淡绿色,Y溶液呈黄色.它们之间有如图1所示转化关系.
请回答:
(1)若通入标准状况下22.4L甲,则被氧化的物质的物质的量为$\frac{2}{3}$mol.
(2)将甲通入石蕊溶液中发生的颜色变化为图2,请在方框内填写出导致该阶段颜色变化的粒子符号.
(3)请写出证明甲、乙非金属性强弱的一个化学反应方程式Cl2+2NaBr=2NaCl+Br2.
(4)在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入乙,乙被还原,由此可推断溶液中一定含有I-离子;一定不含有NO3-和Fe3+离子.
分析 乙通常状况下是深红棕色液体,应为Br2,甲、乙是同主族非金属元素组成的单质,甲可置换出乙,甲为Cl2,X溶液呈淡绿色,则X为FeBr2,Y溶液呈黄色,则Y为FeCl3,据此解答.
解答 解:乙通常状况下是深红棕色液体,应为Br2,甲、乙是同主族非金属元素组成的单质,甲可置换出乙,甲为Cl2,X溶液呈淡绿色,则X为FeBr2,Y溶液呈黄色,则Y为FeCl3,
(1)若通入标准状况下22.4L甲为氯气,其物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,根据氧化还原反应定量关系可知,2FeBr2+3Cl2=2FeCl3+2Br2,被氧化的FeBr2物质的量为:$\frac{2}{3}$mol;
故答案为:$\frac{2}{3}$mol;
(2)将氯气通入石蕊溶液中反应生成HCl、HClO,溶液呈酸性,H+使溶液变为红色,HClO具有漂白性,又使溶液红色褪去,溶液中最终溶解氯气,使溶液呈黄绿色,
故答案为:H+;HClO;Cl2;
(3)甲、乙非金属性强弱是非金属性强弱,利用单质氧化剂的氧化性大于氧化产物作为依据比较非金属强弱,反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2;
故答案为:Cl2+2NaBr=2NaCl+Br2;
(4)酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入Br2被还原,证明溶液中存在还原性的离子I-,根据离子共存可知氧化性的离子Fe3+、NO3-不能存在,所以溶液中一定含有I-;一定不含NO3-和Fe3+;
故答案为:I-;NO3-和Fe3+.
点评 本题考查无机物的推断,涉及Fe、Cl、Br元素化合物性质、氧化还原反应、氯气的制备、离子共存等,题目较为综合,明确物质的种类为解答该题的关键,难度中等.

 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
| A. | Na+ | B. | HCO3- | C. | CO32- | D. | Cl- |
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |
| A. | 石油裂化的主要目的是为了提高轻质油的质量和产量 | |
| B. | 石油分馏所得到的馏分是一种具有固定熔沸点的纯净物 | |
| C. | 可燃冰、干冰和冰的主要化学成分相同 | |
| D. | 石油的裂化、分馏、裂解等都是化学变化 |
| A. | 将明矾加入海水中静置过滤是海水淡化的方法之一 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 海水中提取镁的过程不涉及氧化还原反应 | |
| D. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
| A. | HCl中存在离子键,属于离子化合物 | |
| B. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| C. | 阴阳离子通过静电引力而形成的化学键称为离子键 | |
| D. | 非金属元素组成的化合物中只含共价键 |

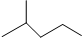 表示的分子式C6H14;名称2-甲基戊烷.
表示的分子式C6H14;名称2-甲基戊烷.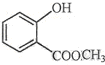 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基. 3-甲基-1-戊烯.
3-甲基-1-戊烯.