题目内容
3.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
分析 铜和一定量浓硝酸反应,Cu恰好完全反应,反应生成气体(NOx)的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,根据N原子守恒计算反应消耗的硝酸.
解答 解:铜和一定量浓硝酸反应,Cu恰好完全反应,反应生成气体(NOx)的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,
根据N原子守恒,作氧化剂的硝酸的物质的量=n(NOx)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
起酸作用硝酸的物质的量=2n[Cu(NO3)2]=2n(Cu)=2×$\frac{2.56g}{64g/mol}$=0.08mol,
所以参加反应的硝酸的物质的量=0.05mol+0.08mol=0.13mol,
故选B.
点评 本题考查化学方程式有关计算,难度中等,注意利用原子守恒进行计算,侧重考查学生的分析计算能力.

练习册系列答案
相关题目
11.加“碘”食盐较多使用的碘酸钾(KIO3),在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑.下列有关说法不正确的是( )
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产不利 | |
| D. | 电解后阴极周围溶液的pH升高 |
8.现有如图4个装置图,则以下说法中正确的是( )
| A. | 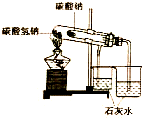 装置可用于比较NaHCO3和Na2CO3的稳定性 | |
| B. | 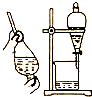 用酒精萃取溴水中的溴可选择装置 | |
| C. |  如图装置进行实验可看到酸性KMnO4溶液褪色 | |
| D. | 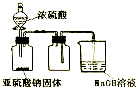 如图装置可用于实验室制取并收集少量SO2 |
15.某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )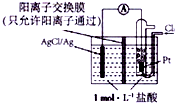

| A. | 正极为Pt电极,电极反应为2Ag++Cl2+2e-═2AgCl↓ | |
| B. | 放电时,交换膜两侧溶液中盐酸浓度不变 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 |
10.已知H2(g)+I2(g)?2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |

 .
.
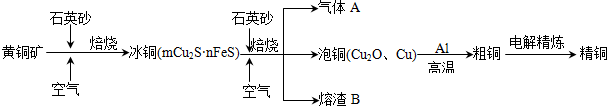
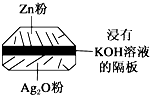 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):