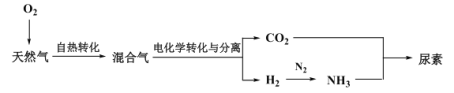
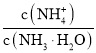题目内容
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是

A.25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg![]() 的变化关系
的变化关系
D.Ka1(H2CO3)的数量级为10-7
【答案】D
【解析】
H2CO3的Ka1=![]() 、Ka2=
、Ka2=![]() ,Ka1Ka2,当c(H+)相同时,
,Ka1Ka2,当c(H+)相同时,![]()
![]() ,根据图像知,n曲线代表pH与-lg
,根据图像知,n曲线代表pH与-lg![]() 的变化关系,m曲线代表pH与-lg
的变化关系,m曲线代表pH与-lg![]() 的变化关系;据此分析作答。
的变化关系;据此分析作答。
A.H2CO3的电离平衡常Ka2=![]() ,在M点,-lg
,在M点,-lg![]() =1,则
=1,则![]() =10-1,pH=9.3,c(H+)=10-9.3 mol/L,则Ka2=10-10.3,25 ℃时,CO32-+H2O
=10-1,pH=9.3,c(H+)=10-9.3 mol/L,则Ka2=10-10.3,25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() ,A错误;
,A错误;
B.溶液中电荷守恒为:c(Na+) +c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),溶液呈中性时,c(H+)=c(OH-),则c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),B错误;
C.H2CO3的Ka1=![]() 、Ka2=
、Ka2=![]() ,Ka1Ka2,当c(H+)相同时,
,Ka1Ka2,当c(H+)相同时,![]()
![]() ,根据图像知,n曲线代表pH与-lg
,根据图像知,n曲线代表pH与-lg![]() 的变化关系,m曲线代表pH与-lg
的变化关系,m曲线代表pH与-lg![]() 的变化关系,C错误;
的变化关系,C错误;
D.H2CO3的Ka1=![]() ,在N点,-lg
,在N点,-lg![]() =-1,则
=-1,则![]() =10,pH=7.4,c(H+)=10-7.4 mol/L,Ka1=10-6.4,Ka1(H2CO3)的数量级为10-7,D正确;
=10,pH=7.4,c(H+)=10-7.4 mol/L,Ka1=10-6.4,Ka1(H2CO3)的数量级为10-7,D正确;
故选D。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2