题目内容
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
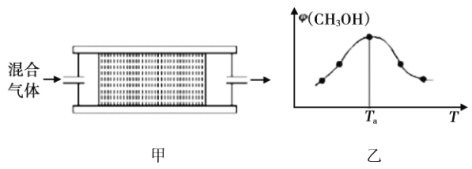
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
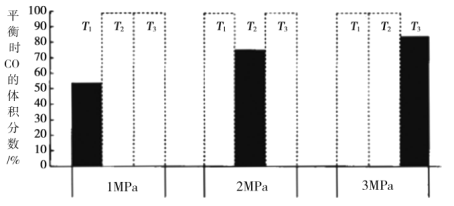
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
【答案】413.4 温度低于![]() 时未达平衡,温度升高、反应速率加快,
时未达平衡,温度升高、反应速率加快,![]() 的体积分数增大;高于
的体积分数增大;高于![]() 时,温度升高平衡逆向移动,
时,温度升高平衡逆向移动,![]() 的体积分数减小
的体积分数减小 ![]()
![]()
![]() 压强越大,
压强越大,![]() 的体积分数越小,
的体积分数越小,![]() 对应的
对应的![]() 的体积分数逐渐增大,该反应向逆反应方向移动,则
的体积分数逐渐增大,该反应向逆反应方向移动,则![]()
【解析】
(1)已知![]() ,由于H=反应物总键能-生成物总键能计算解答;
,由于H=反应物总键能-生成物总键能计算解答;
(2)反应![]() 为放热反应,根据温度对该反应平衡移动的影响分析;
为放热反应,根据温度对该反应平衡移动的影响分析;
(3)根据表格分析判断平衡状态,结合相同条件下压强之比等于物质的量之比,列“三段式”进行计算;
(4)根据反应![]() 在温度和压强的影响下平衡移动的方向使
在温度和压强的影响下平衡移动的方向使![]() 的体积分数(%)变化分析判断。
的体积分数(%)变化分析判断。
(1)已知![]() ,由于H=反应物总键能-生成物总键能=(2×436+1075)
,由于H=反应物总键能-生成物总键能=(2×436+1075)![]() -(3a+462.8+351)
-(3a+462.8+351)![]() =-107
=-107![]() ,解得a=413.4
,解得a=413.4![]() ;
;
(2)反应![]() 为放热反应,φ(CH3OH)变化的原因是:温度低于
为放热反应,φ(CH3OH)变化的原因是:温度低于![]() 时未达平衡,温度升高、反应速率加快,
时未达平衡,温度升高、反应速率加快,![]() 的体积分数增大;高于
的体积分数增大;高于![]() 时,温度升高平衡逆向移动,
时,温度升高平衡逆向移动,![]() 的体积分数减小;
的体积分数减小;
(3)根据表格分析反应进行到20min时达到平衡状态,初始体系压强为12.6MPa,平衡时体系的压强为8.4 MPa,设平衡时CO物质的量变化量为x,列“三段式”:
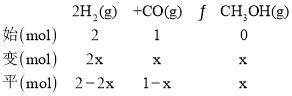
结合相同条件下压强之比等于物质的量之比,则![]() ,解得x=0.5mol,则v(CO)=
,解得x=0.5mol,则v(CO)=![]() =
= =0.0125mol/(Lmin),平衡常数K=
=0.0125mol/(Lmin),平衡常数K=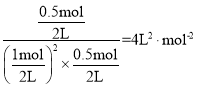 ;
;
(4)根据反应![]() ,压强越大,平衡正向移动,
,压强越大,平衡正向移动,![]() 的体积分数越小,根据图像,
的体积分数越小,根据图像,![]() 对应的
对应的![]() 的体积分数逐渐增大,说明该反应向逆反应方向移动,该反应正向放热,升高温度,平衡逆向移动,则
的体积分数逐渐增大,说明该反应向逆反应方向移动,该反应正向放热,升高温度,平衡逆向移动,则![]() 。
。

【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度