题目内容
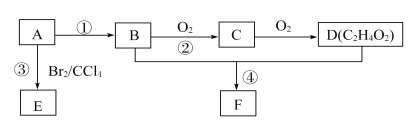
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
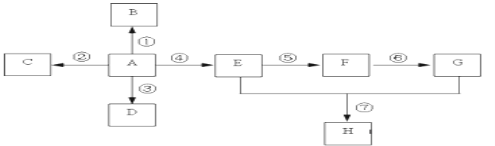
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式
反应①__________________;
反应⑤_____________________;
反应⑦ _______________________。
(3)写出下列反应类型:反应④___________,反应⑤___________。
【答案】碳碳双键; 羟基 ![]() 2CH3CH2OH+O 2
2CH3CH2OH+O 2![]() 2 CH3CHO+2H2O CH3CH2OH+CH3COOH
2 CH3CHO+2H2O CH3CH2OH+CH3COOH CH3CH2OOCCH3+H2O 加成反应 氧化反应
CH3CH2OOCCH3+H2O 加成反应 氧化反应
【解析】
A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30,即A为CH2=CH2,B为聚乙烯,C为二氧化碳,D为乙烷,E为乙醇,F为乙醛,G为乙酸,H为乙酸乙酯。
(1)由分析可知,A为CH2=CH2,E为乙醇,A、E含有的官能团分别为:碳碳双键、羟基;
(2)反应①:为乙烯加聚成聚乙烯,其化学反应方程式为:![]() ;
;
反应⑤:为乙醇催化氧化为乙醛,其化学反应方程式为:2CH3CH2OH+O 2![]() 2 CH3CHO+2H2O;
2 CH3CHO+2H2O;
反应⑦:为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,其化学反应方程式为:CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O;
CH3CH2OOCCH3+H2O;
(3)反应④为乙烯与水加成为乙醇,属于加成反应。反应⑤为乙醇催化氧化为乙醛,属于氧化反应。

 阅读快车系列答案
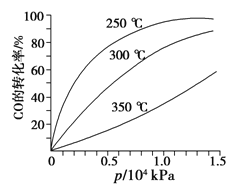
阅读快车系列答案【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7