题目内容
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________。利用反应6NO2+ 8NH3![]() 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a 体系压强保持不变 b 混合气体颜色保持不变
c SO3和NO的体积比保持不变 d 每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=__________。
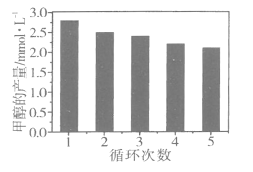
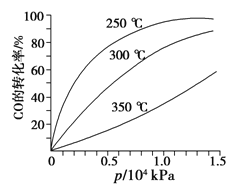
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
【答案】3NO2+H2O=NO+2HNO3 6.72 -41.8 b K=c(SO3).c(NO)/[c(NO2).c(SO2)] <
【解析】
(1)NO2可用水吸收生成硝酸和一氧化氮。由关系式NO2 ~4e-,结合V=n×Vm计算可得;
(2)由盖斯定律计算ΔH。判断平衡状态紧抓“逆向相等,变量不变”的特征。平衡常数等于可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比;
(3)由图像可知,压强相同时,温度越大,CO的平衡转化率越小,平衡正向移动。
(1)NO2可用水吸收生成硝酸和一氧化氮,相应的化学反应方程式为3NO2+H2O=NO+2HNO3。反应6NO2+ 8NH3![]() 7N2+12 H2O中,NO2 化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=1.2mol/4=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
7N2+12 H2O中,NO2 化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=1.2mol/4=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
(2)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)可以由已知方程式(①-②)/2得到,所以ΔH=(ΔH1-ΔH2)/2=-41.8 kJ·mol-1。
SO3(g)+NO(g)可以由已知方程式(①-②)/2得到,所以ΔH=(ΔH1-ΔH2)/2=-41.8 kJ·mol-1。
a. 该反应前后气体分子数不变,所以反应前后压强始终不变,压强不变不能判断达平衡,故a错误;
b. 反应物NO2 呈红棕色,随着反应进行NO2 不断变化,颜色不断变化,当不变时,NO2浓度不变可以说明达到平衡,故b正确;
c. 生成物SO3:NO始终等于1:1,所以体积比不随反应而改变,不能判定达平衡,故c错误;
d.每消耗1 mol SO3的同时生成1molNO2 不能表示正反应速率等于逆反应速率,不能判定达平衡,故d错误;
答案选b。
平衡常数等于可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比,则该温度下,此反应的平衡常数表达式K=c(SO3).c(NO)/[c(NO2).c(SO2)];
(3)由图像可知,压强相同时,温度越大,CO的平衡转化率越小,所以升温对正反应不利,正反应是个放热反应,ΔH<0。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案