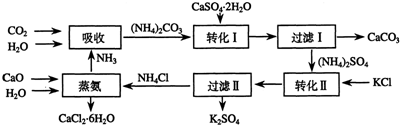
题目内容
20.常温下,浓度均为0.1mol•L-1的下列溶液,pH由大到小的顺序是( )①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
分析 酸性越强,pH越小,且pH<7,碱性越强,pH越大,且pH>7,不水解的盐,常温下呈中性,pH=7,据此解答即可.
解答 解:①H2SO4溶液和②盐酸均为强酸溶液,pH<7,且硫酸为二元酸,故硫酸酸性大于盐酸,即pH值,硫酸<盐酸;④NaOH溶液和⑤Ba(OH)2溶液均为强碱溶液,pH>7,且氢氧化钡为二元强碱,故pH值,氢氧化钡>氢氧化钠,③NaCl溶液呈中性,pH=7,故pH由大到小的顺序是:⑤>④>③>②>①,
故选A.
点评 本题主要考查pH的有关计算,熟悉Kw及氢离子的浓度的换算是解答的关键,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
11.在0℃和1.01×105 Pa条件下,将0.1g H2、3.2g SO2、2.2g CO2混合,该混合气的体积是( )
| A. | 2.24 L | B. | 3.36 L | C. | 4.48 L | D. | 6.72 L |
12.某密闭容器中充入的NO和O2的物质的量分别是a和b,待反应后容器内氮原子数和氧原子数之比为( )
| A. | a:b | B. | a:2b | C. | a:2(a+b) | D. | a:(a+2b) |
9.物质的量为a 的CaCl2溶解在1mol H2O中,测得溶液中Cl-离子与H2O分子的物质的量之比为1:10,则a为( )
| A. | 0.05mol | B. | 0.1mol | C. | 0.5mol | D. | 10mol |
10.电解水生成氢气和氧气这一事实说明( )
| A. | 水是由氢气和氧气组成的 | |
| B. | 水是由2个氢原子和1个氧原子构成的 | |
| C. | 水是由2个氢元素和1个氧元素组成的 | |
| D. | 水是由氢元素和氧元素组成的 |