题目内容
11.在0℃和1.01×105 Pa条件下,将0.1g H2、3.2g SO2、2.2g CO2混合,该混合气的体积是( )| A. | 2.24 L | B. | 3.36 L | C. | 4.48 L | D. | 6.72 L |
分析 0℃和1.01×105 Pa为标准状况,可根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算该题.
解答 解:n(H2)=$\frac{0.1g}{2g/mol}$=0.05mol,n(SO2)=$\frac{3.2g}{64g/mol}$=0.05mol,n(CO2)=$\frac{2.2g}{44g/mol}$=0.05mol,
则体积为0.05mol×3×22.4L/mol=3.36 L,
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关公式的运用以及答题思路,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.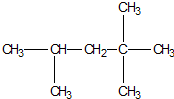 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )| A. | C2H4 | B. | C8H18 | C. | C7H16 | D. | C6H12 |
16.下列叙述中正确的是( )
①能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
②某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
③某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+.
①能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
②某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
③某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+.
| A. | ①②③ | B. | ①② | C. | ②③ | D. | 无 |
20.常温下,浓度均为0.1mol•L-1的下列溶液,pH由大到小的顺序是( )
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
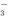 +H+
+H+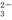 +H2O?HCO
+H2O?HCO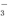 +OH-
+OH-