题目内容
5.将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系可由图表示.在下列因素中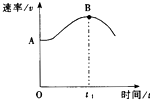
①盐酸的浓度 ②镁带的表面积 ③溶液的浓度 ④氢气的压强 ⑤Cl-的浓度
(1)影响反应速率的因素①②③;
(2)解释图中AB段形成的原因镁条与盐酸反应放热,温度升高,反应速度加快;
(3)解释图中t1时刻后速率变小的原因反应进行,盐酸浓度减小,反应物浓度减小,反应速度减慢.
分析 (1)影响反应速率的因素有:温度、浓度、催化剂、接触面积等;
(2)温度越高反应速率越快,离子浓度越大反应速率越快;
(3)离子浓度越小反应速率越慢.
解答 解:(1)影响该反应速率的因素有:温度、氢离子浓度、催化剂、接触面积等,虽然生成物中有气体,但该反应是在敞口容器中,外界大气压不变,所以氢气压强不影响反应速率,故选①②③;
(2)温度越高反应速率越快,离子浓度越大反应速率越快,该反应是放热反应,随着反应的进行,溶液温度升高,溶液中离子浓度降低,但温度影响大于离子浓度影响,所以反应速率加快,故答案为:镁条和盐酸的反应放热,温度升高,反应速率加快;
(3)离子浓度越小反应速率越慢,随着反应的进行,溶液中氢离子浓度降低,虽然溶液温度升高,但离子浓度影响大于温度升高,所以反应速率减慢,
故答案为:反应进行,盐酸浓度减小,反应物浓度减小,反应速率减慢.
点评 本题考查外界影响因素对化学反应速率的影响,侧重考查基本理论,明确外界影响因素及其原理,注意外界因素只是影响因素,起决定性作用的是物质本身性质.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
16.下列叙述中正确的是( )
①能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
②某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
③某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+.
①能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
②某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
③某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+.
| A. | ①②③ | B. | ①② | C. | ②③ | D. | 无 |
13.硅是“21世纪的能源”.假如硅作为一种普遍使用的新型能源被开发利用,下列说法中,你认为不妥的是( )
| A. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 | |
| B. | 自然界中存在大量的单质硅 | |
| C. | 硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制 | |
| D. | 硅常用作太阳能电池的材料 |
20.常温下,浓度均为0.1mol•L-1的下列溶液,pH由大到小的顺序是( )
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
14.在标准状况下,有:①10mL H2O;②100mL O2;③220mL 氖气;④120mL CO2,这四种物质的物质的量由小到大的顺序为( )
| A. | ④③②① | B. | ②④③① | C. | ①②③④ | D. | ①②④③ |
 1mol/LNH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是
1mol/LNH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是 在通常状况下,A为固体单质,如图所示的转化关系,回答:
在通常状况下,A为固体单质,如图所示的转化关系,回答: