题目内容
8.(1)工业上用金属铝与软锰矿(主要成分是MnO2)反应来制取金属锰,写出反应的化学方程式:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.(2)铍元素与铝元素性质相似,铍的最高价氧化物的水化物属于两性化合物,证明这一结论的有关离子方程式为Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O.
(3)由金红石(TiO2)制取金属Ti的步骤为TiO2$→_{高温}^{Cl_{2},C}$TiCl4$→_{800℃,Ar}^{Mg}$Ti,上述由TiO2制取TiCl4时还生成了一种可燃性气体,写出该反应的化学方程式:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO(或TiO2+2C$\frac{\underline{\;高温\;}}{\;}$Ti+2CO↑,Ti+2Cl2═TiCl4);TiCl4→Ti的反应在氩气中而不是在空气中进行的原因是防止高温下镁或钛与空气中的O2(或CO2、N2)反应.
(4)某品牌的铸造铝合金由Al、Si、Cu、Mg构成,对铸造铝合金中所含的四种成分做如下的实验检测:
①称取18.0g铸造铝合金样品,分成等质量的A、B两份.向A份中加入足量的稀盐酸,B份中加入足量NaOH溶液.(已知:Si+2NaOH+H2O═Na2SiO3+2H2↑)
②待两份样品都充分反应之后,称得B份滤渣的质量较A份少0.512g,收集得到的两份气体的体积B份较A份多851.2mL(标准状况下).则18.0g铸造铝合金样品中Mg的物质的量为0.004mol,Si的质量分数为6.2%.
分析 (1)铝与软锰矿(主要成分是MnO2)反应来制取金属锰,还生成氧化铝;
(2)两性化合物与强酸、强碱均反应生成盐和水;
(3)TiO2制取TiCl4时还生成了一种可燃性气体,由元素守恒可知为CO;TiCl4→Ti的反应在氩气中而不是在空气中与Ti易被氧化有关;
(4)能和NaOH反应的物质有Si和Al,能和稀盐酸反应的物质有Mg和Al,铝的质量相同,铝和稀盐酸或氢氧化钠溶液生成的氢气物质的量相等,A中滤渣为Cu和Mg、B中滤渣为Si和Cu,所以两种滤渣质量差为Si和Mg的质量差,生成气体体积差为Mg、Si产生气体差,
设Si的物质的量为xmol、Mg的物质的量为ymol,
28xg-24yg=0.512g ①
4xmol-2ymol=$\frac{0.8512L}{22.4L/mol}$×2②
联立方程式①②计算Si、Mg的物质的量,以此来解答.
解答 解:(1)铝与软锰矿(主要成分是MnO2)反应来制取金属锰,还生成氧化铝,反应为4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,故答案为:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn;
(2)两性化合物与强酸、强碱均反应生成盐和水,离子反应分别为Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O,
故答案为:Be(OH)2+2H+═Be2++2H2O;Be(OH)2+2OH-═BeO22-+2H2O;
(3)TiO2制取TiCl4时还生成了一种可燃性气体,由元素守恒可知为CO,该转化的反应为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO(或TiO2+2C$\frac{\underline{\;高温\;}}{\;}$Ti+2CO↑,Ti+2Cl2═TiCl4),TiCl4→Ti的反应在氩气中而不是在空气中进行的原因是防止高温下镁或钛与空气中的O2(或CO2、N2)反应,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO(或TiO2+2C$\frac{\underline{\;高温\;}}{\;}$Ti+2CO↑,Ti+2Cl2═TiCl4);防止高温下镁或钛与空气中的O2(或CO2、N2)反应;
(4)能和NaOH反应的物质有Si和Al,能和稀盐酸反应的物质有Mg和Al,铝的质量相同,铝和稀盐酸或氢氧化钠溶液生成的氢气物质的量相等,A中滤渣为Cu和Mg、B中滤渣为Si和Cu,所以两种滤渣质量差为Si和Mg的质量差,生成气体体积差为Mg、Si产生气体差,
设Si的物质的量为xmol、Mg的物质的量为ymol,
28xg-24yg=0.512g ①
4xmol-2ymol=$\frac{0.8512L}{22.4L/mol}$×2②,
x=0.02、y=0.002,
称取18.0g铸造铝合金样品,分成等质量的A、B两份,则18.0g铸造铝合金样品中Mg的物质的量0.002mol×2=0.004mol,
Si的质量分数为为$\frac{0.002×2×28g/mol}{18.0g}$×100%=6.2%,故答案为:0.004 mol;6.2%.
点评 本题考查金属及化合物的性质及应用,为高频考点,侧重分析与应用能力的综合考查,把握发生的反应为解答的关键,(4)中计算为解答的难点,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案①能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
②某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
③某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+.
| A. | ①②③ | B. | ①② | C. | ②③ | D. | 无 |
| A. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 | |
| B. | 自然界中存在大量的单质硅 | |
| C. | 硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制 | |
| D. | 硅常用作太阳能电池的材料 |
①H2SO4溶液
②盐酸
③NaCl溶液
④NaOH溶液
⑤Ba(OH)2溶液.
| A. | ⑤>④>③>②>① | B. | ①>②>③>④>⑤ | C. | ④=⑤>③>①=② | D. | ①=②>③>④=⑤ |
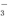 +H+
+H+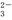 +H2O?HCO
+H2O?HCO +OH-
+OH-