题目内容
4.NA为阿伏加德罗常数,下列关于0.2mol/L K2SO4溶液的正确说法是( )| A. | 1L溶液中K+离子浓度是0.2mol/L | |
| B. | 500mL溶液中含有0.1NA个K+离子 | |
| C. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2L溶液中SO42-离子浓度是0.4mol/L |
分析 A、离子浓度与所取溶液的体积无关;
B、求出硫酸钾的物质的量,然后根据1mol硫酸钾中含2mol钾离子来分析;
C、求出硫酸钾的物质的量,然后根据1mol硫酸钾中含2mol钾离子和1mol硫酸根来分析;
D、离子浓度与所取溶液的体积无关.
解答 解:A、根据硫酸钾的化学式可知,钾离子的浓度是硫酸钾浓度的2倍.故K+离子浓度是0.4mol/L,与所取溶液的体积无关,故A错误;
B、溶液中硫酸钾的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1mol硫酸钾中含2mol钾离子,故0.1mol硫酸钾中含0.2mol钾离子即0.2NA个,故B错误;
C、溶液中硫酸钾的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1mol硫酸钾中含2mol钾离子和1mol硫酸根,故0.1mol硫酸钾中含0.2mol钾离子和0.1mol硫酸根共0.3mol离子即0.3NA个,故C正确;
D、根据硫酸钾的化学式可知,硫酸根离子的浓度与硫酸钾浓度相等,故硫酸根的浓度为0.2mol/L,浓度与所取溶液的体积无关,故D错误;
故选C.
点评 本题考查了物质的量、物质的量浓度的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
12.下列过程中,需吸收能量的是( )
| A. | H+H→H2 | B. | 天然气燃烧 | C. | I2→I+I | D. | S+O2→SO2 |
19.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
请回答:
(1)从a组情况分析,HA是强酸还是弱酸HA是弱酸.
(2)b组情况表明,c>0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)= c(Na+).(选填“>”、“<”或“=”)
(3)a组实验所得混合溶液中由水电离出的c(OH-)=10-5 mol•L-1.
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
(1)从a组情况分析,HA是强酸还是弱酸HA是弱酸.
(2)b组情况表明,c>0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)= c(Na+).(选填“>”、“<”或“=”)
(3)a组实验所得混合溶液中由水电离出的c(OH-)=10-5 mol•L-1.
16.下列有关实验现象的描述中,正确的是( )
| A. | 氢气在氯气中剧烈燃烧,产生苍白色火焰,有白雾生成 | |
| B. | 铁在氯气中剧烈燃烧,生成蓝色的氯化铁颗粒 | |
| C. | 过氧化钠投入水中,会产生气泡 | |
| D. | 钠在空气中剧烈燃烧,得到白色粉末状固体 |
14.NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA个 | |
| D. | 常温常压下,1mol氦气含有的原子数为2NA |
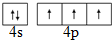 .
.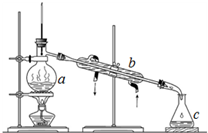 蒸馏是对混合物进行分离提纯的一种重要方法,其装置如图I.
蒸馏是对混合物进行分离提纯的一种重要方法,其装置如图I.