题目内容
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C、氧化剂得电子总数与还原剂失电子总数之比为1:1 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Cl2+6NaOH
5NaCl+NaClO3+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
| ||
解答:
解:A.只有Cl元素的化合价变化,则氯气既是氧化剂又是还原剂,故A错误;
B.状况未知,不能利用体积计算物质的量,则不能计算转移电子,故B错误;
C.由电子守恒可知,氧化剂得电子总数与还原剂失电子总数之比为1:1,故C正确;
D.由元素的化合价变化及原子守恒可知,1个Cl原子失去电子,5个Cl原子得到电子,则被氧化的氯原子和被还原的氯原子的物质的量之比为1:5,故D错误;
故选C.
B.状况未知,不能利用体积计算物质的量,则不能计算转移电子,故B错误;
C.由电子守恒可知,氧化剂得电子总数与还原剂失电子总数之比为1:1,故C正确;
D.由元素的化合价变化及原子守恒可知,1个Cl原子失去电子,5个Cl原子得到电子,则被氧化的氯原子和被还原的氯原子的物质的量之比为1:5,故D错误;
故选C.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化和氧化还原反应基本概念即可解答,注重基础知识的考查,注意电子守恒和原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
下列图示的有关说法正确的是( )
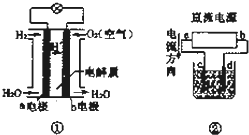

| A、装置①中负极反应式为H2+2e-═2H+ |
| B、装置①工作时,外电路电子由a电极流向b电极 |
| C、若采用装置②精炼铜,则d为粗铜,c为纯铜 |
| D、若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
下列说法正确的是( )
| A、糖类物质的分子式都可以用Cn(H2O)m表示 |
| B、凡能溶于水且具有甜味的化合物都属于糖类 |
| C、糖类一定能发生水解反应 |
| D、糖类不一定能发生银镜反应 |
同一周期元素,其原子结构相同之处是( )
| A、最外层电子数相等 |
| B、核电荷数相等 |
| C、电子层数相等 |
| D、核外电子数相等 |
常温下,将等体积、等浓度的盐酸和氨水混合,在所得溶液中离子浓度关系正确的是( )
| A、c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| B、c(Cl-)+c(OH-)=c(NH4+)+c(H+) |
| C、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列说法正确的是( )
A、按系统命名法  的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 |
| B、氨基酸常温下为固体,其熔点高的主要原因是分子间存在氢键 |
| C、某烃完全燃烧时产生的n(H2O)>n(CO2),是其肯定属于烷烃 |
| D、取等质量的乙烯和聚丙烯分别燃烧,它们的耗氧量不相同 |