题目内容
碳酸钠、明矾都是重要的化合物,在生活、生产中有着重要用途.结合化学用语和适当的语言叙述回答下列各题.
(1)用碳酸钠溶液清洗油污,加热可以增强其去污力: .
(2)明矾[KAl(SO4)2?12H2O]可以用来做净水剂的原因是: ,向明矾溶液中逐滴加入Ba(OH)2溶液,至硫酸根离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”),总反应离子方程式为 .
(3)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3,试写出SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式: .
(1)用碳酸钠溶液清洗油污,加热可以增强其去污力:
(2)明矾[KAl(SO4)2?12H2O]可以用来做净水剂的原因是:
(3)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体.蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3,试写出SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式:
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)盐类水解是吸热反应,升高温度促进水解;
(2)明矾中铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有很强的吸附性;假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;
(3)根据“SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体、使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3”写出SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式.
(2)明矾中铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有很强的吸附性;假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;
(3)根据“SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体、使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3”写出SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式.
解答:
解:(1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2O?HCO3-+OH-,碱性越强,油污的水解程度越大,导致去污能力越强,盐类水解是吸热反应,升高温度促进水解,所以去污能力越强,
故答案为:CO32-+H2O?HCO3-+OH-,升温可以促进碳酸钠的水解,使溶液中c(OH-)增大;
(2)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,反应的离子方程式为Al3++3H2O?Al(OH)3+3H+;
假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7,
故答案为:明矾溶于水发生水解Al3++3H2O?Al(OH)3+3H+生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质;=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;
(3)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,该两种气体应该为氯化氢和二氧化硫;使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3,反应生成、氯化铝、二氧化硫和氯化氢气体,所以SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式:6SOCl2+AlCl3?6H2O
12HCl+6SO2↑+AlCl3,
故答案为:6SOCl2+AlCl3?6H2O
12HCl+6SO2↑+AlCl3.
故答案为:CO32-+H2O?HCO3-+OH-,升温可以促进碳酸钠的水解,使溶液中c(OH-)增大;
(2)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,反应的离子方程式为Al3++3H2O?Al(OH)3+3H+;
假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7,
故答案为:明矾溶于水发生水解Al3++3H2O?Al(OH)3+3H+生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质;=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;
(3)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,该两种气体应该为氯化氢和二氧化硫;使SOCl2与AlCl3?6H2O混合并加热,可得到无水AlCl3,反应生成、氯化铝、二氧化硫和氯化氢气体,所以SOCl2与AlCl3?6H2O混合加热发生反应的化学方程式:6SOCl2+AlCl3?6H2O
| ||
故答案为:6SOCl2+AlCl3?6H2O
| ||
点评:本题考查了盐的水解原理及其应用,题目难度中等,注意掌握盐的水解原理及影响因素,明确明矾净水原理、碳酸钠除油污原理,(3)为易错点,注意含量分析题干信息.

练习册系列答案
相关题目
在相同温度下,100mL 0.1mol?L-1的醋酸与10mL 1mol?L-1的醋酸相比较,下列说法正确的是( )
| A、溶液中H+的物质的量前者大于后者 |
| B、前者的电离程度小于后者 |
| C、发生中和反应时所需NaOH的量前者大于后者 |
| D、溶液中CH3COOH的物质的量前者大于后者 |
几种短周期元素的原子半径及主要化合价如下表:下列说法正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 140 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性X<Y |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的氢氧化物能溶于稀氨水 |
| D、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C、氧化剂得电子总数与还原剂失电子总数之比为1:1 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.

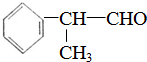 的一种香料.
的一种香料.