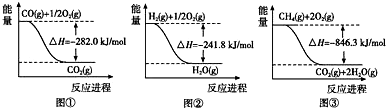
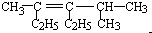题目内容
常温下,将等体积、等浓度的盐酸和氨水混合,在所得溶液中离子浓度关系正确的是( )
| A、c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| B、c(Cl-)+c(OH-)=c(NH4+)+c(H+) |
| C、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:常温下,将等体积、等浓度的盐酸和氨水混合,二者恰好反应生成NH4Cl,氯化铵为强酸弱碱盐,铵根离子水解而使溶液呈酸性,再结合电荷守恒解答.
解答:
解:常温下,将等体积、等浓度的盐酸和氨水混合,二者恰好反应生成NH4Cl,氯化铵为强酸弱碱盐,铵根离子水解而使溶液呈酸性,即c(H+)>c(OH-),溶液中存在电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),所以正确的为B选项,
故选B.
故选B.
点评:本题考查了盐类水解,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒分析解答,题目难度不大.

练习册系列答案
相关题目
对于反应3Cl2+6NaOH
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| ||
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C、氧化剂得电子总数与还原剂失电子总数之比为1:1 |
| D、被氧化的氯原子和被还原的氯原子的物质的量之比为5:1 |
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A≤B;⑤A的正价与B的负价绝对值不一定相等.其中正确的是( )
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A≤B;⑤A的正价与B的负价绝对值不一定相等.其中正确的是( )
| A、①② | B、③④⑤ | C、③⑤ | D、③④ |
以下化学用语不正确的是( )
| A、乙炔的最简式 CH |
B、CH4的球棍模型: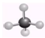 |
| C、乙烯的结构简式CH2CH2 |
| D、乙醇的结构简式C2H5OH |
下列表述正确的是( )
| A、人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅 |
| B、化学家采用玛瑙研钵研磨固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 |
| C、三峡大坝的建成使用了大量水泥,水泥是新型无机非金属材料 |
| D、太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、煤的干馏和石油的分馏均属化学变化 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、HD与D2互为同位素;金刚石、石墨和C60互为同素异形体 |
| D、苯酚有一定毒性,不能作消毒剂和防腐剂 |
下列结论不正确的是( )
| A、粒子半径:S>S2->Cl- |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、金属性:Na>Mg>Al |
| D、氢化物稳定性:HF>H2O>NH3 |