题目内容
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
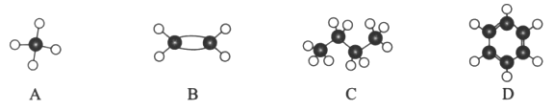
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
【答案】 ![]() 离子
离子 ![]() 极性 C B
极性 C B ![]() CH4+Cl2
CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
【解析】Ⅰ.(1).氢元素的核电荷数为1,其原子结构示意图为 ![]() ;钠在氯气中燃烧生成氯化钠,含有离子键。 (2).氢元素和氯元素形成氯化氢,其电子式为
;钠在氯气中燃烧生成氯化钠,含有离子键。 (2).氢元素和氯元素形成氯化氢,其电子式为 ![]() ;该物质含有极性键;Ⅱ.A为甲烷,B为乙烯,C为丁烷,D为苯。(1)和甲烷互为同系物的为丁烷,选C;(2)乙烯能使酸性高锰酸钾溶液褪色;(3).丁烷的同分异构体为2-甲基丙烷,结构简式为
;该物质含有极性键;Ⅱ.A为甲烷,B为乙烯,C为丁烷,D为苯。(1)和甲烷互为同系物的为丁烷,选C;(2)乙烯能使酸性高锰酸钾溶液褪色;(3).丁烷的同分异构体为2-甲基丙烷,结构简式为 ![]() ;(4).甲烷和氯气反应生成一氯甲烷和氯化氢,方程式为: CH4+Cl2
;(4).甲烷和氯气反应生成一氯甲烷和氯化氢,方程式为: CH4+Cl2![]() CH3Cl+HCl。
CH3Cl+HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
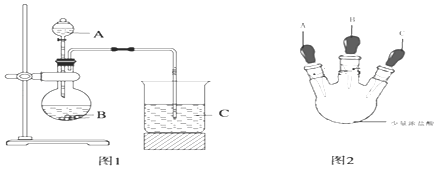
小学生10分钟应用题系列答案【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
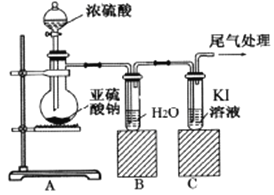
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。