题目内容
【题目】如图是人类从海水资源中提取某些重要化工原料的流程示意图:
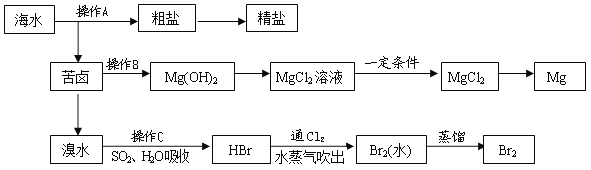
请回答下列问题:
(1)操作A是__________________和过滤(填实验基本操作名称)
(2)操作B需加入下列试剂中的一种,最合适的是________(选填编号)
A. 氢氧化钠溶液 B. 澄清石灰水
C. 石灰乳 D. 碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是_____________________,用SO2水溶液吸收Br2 ,吸收率可达95%,有关反应的离子方程式为___________________。
(4)工业上由无水MgCl2制取镁的化学方程式为____________________。
【答案】 蒸发结晶 c Cl2+2Br-=Br2+2Cl- Br2+SO2+2H2O=4H++SO42﹣+2Br- MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】海水晒盐过滤得到苦卤和粗盐,粗盐精制得到饱和食盐水,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到HBr,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴,据此解答。
(1)食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠;
(2)工业制镁:把海边的贝壳制成生石灰:CaCO3![]() CaO+CO2↑,在海水中加入生石灰:CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,答案选c;
CaO+CO2↑,在海水中加入生石灰:CaO+H2O=Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,答案选c;
(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br-=Br2+2Cl-;用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为Br2+SO2+2H2O=4H++SO42﹣+2Br-;
(4)工业上由无水MgCl2制取镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案