题目内容
【题目】化学是以实验为基础的.利用已学知识对下列实验进行分析并填空:
Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成同主族元素C、Si非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.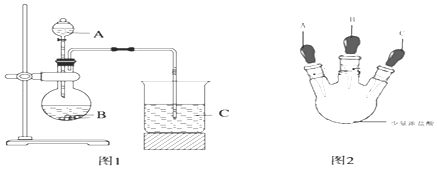
(1)甲同学设计实验所涉及的离子方程为:、 .
(2)乙同学具体操作如下:
①先挤压胶头滴管A,使少量溶液滴入烧瓶内;
②挤压胶头滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为 .
③再挤压胶头滴管C,使少量溶液滴入烧瓶内,可观察到;
(3)根据甲乙同学的实验可得到的结论是:
(4)II.
实验 |
| ||
实验 |
|
|
|
实验 | 结论: | ||
反应 | |||
【答案】
(1)CaCO3+2H+=Ca2++CO2↑+H2O,SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣
(2)Cl2+2Br﹣=2Cl﹣+Br2,溶液由橙黄色变为蓝色
(3)同一主族元素,从上到下,元素的非金属性减弱
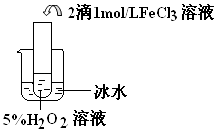
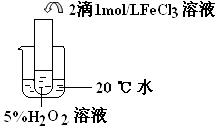
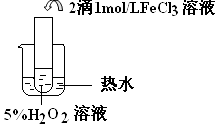
(4)探究温度对H2O2分解反应速率的影响,温度越高,化学反应速率越快,催化剂,2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
【解析】解:Ⅰ.(1)根据实验装置图可知,甲同学利用强酸制弱的原理比较酸性的强弱,利用元素的最高价氧化物的水化物酸性越强,则元素的非金属性超强,判断同主族元素非金属性强弱,能用该实验装置完成的应该是碳元素和硅元素的比较,所以该实验是用碳酸制硅酸,装置A和B是用强酸与碳酸钙反应生成二氧化碳,C中装硅酸钠溶液,将生成的二氧化碳通入硅酸钠溶液,有白色沉淀生成,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣,
所以答案是:CaCO3+2H+=Ca2++CO2↑+H2O、SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣;
(2)②根据实验装置图及题中提供的试剂可知,乙同学利用单质的氧化性越强,元素的非金属性越强的原理比较氯、溴、碘的非金属性,具体操作为先用氯酸钾与浓盐酸反应生成氯气,形成氯水,再向溶液中滴加溴化钠溶液,生成溴,溶液出现橙黄色,反应的离子方程式为2Br﹣+Cl2Br2+2Cl﹣;
所以答案是:2Br﹣+Cl2Br2+2Cl﹣;
③再滴入淀粉碘化钾溶液,溴能氧化碘离子生成碘,溶液由橙黄色变为蓝色,
所以答案是:溶液由橙黄色变为蓝色;
(3)根据(1)可知,碳的非金属性强于硅,(2)可知,氯的非金属性强于溴,溴的非金属性强于碘,所以结论是同一主族元素,从上到下,元素的非金属性减弱,
所以答案是:同一主族元素,从上到下,元素的非金属性减弱;
Ⅱ.比较三个实验装置图可知,三个装置中的温度不同,根据对比实验的原理可其实验目的是探究温度对双氧水分解反应的速率的影响,温度越高,反应速率越快,双氧水越易分解.双氧水在氯化铁作催化剂的条件下发生分解生成氧气和水,反应的方程式为2H2O2 ![]() 2H2O+O2↑,
2H2O+O2↑,
所以答案是:
实验目的:探究温度对H2O2分解反应速率的影响 |
温度越高,化学反应速率越快 催化剂 |
2H2O2 |

【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为__________________________________。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d 四点中,达到平衡状态的是__________________________________。
(3)已知c点时容器中O2浓度为0.02 mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是_____________。
A.CO转化反应的平衡常数K(a)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
Ⅲ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525 mol CO2,则Y的化学式为______________。

(6)实验过程中采用NO模拟NOx,而不采用NO2的原因是____________________________。
【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。