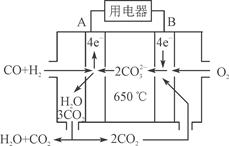
题目内容
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:__________________。
(1) Cl2 + H2O  Cl- + H+ + HClO;(3分)
Cl- + H+ + HClO;(3分)
(2) Cl2 + H2O  Cl- + H+ + HClO(6分)
Cl- + H+ + HClO(6分)
C起 mol/L 0.090 0 0 0
C变mol/L 0.090×1/3 0.030 0.030 0.030
C平mol/L 0.060 0.030 0.030 0.030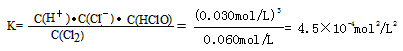
(3)正反应方向; (1分) (4)增大(2分),正反应方向(1分)
(5) Cl2 + H2O  Cl- + H+ + HClO,光照,HClO分解生成HCl和O2,使平衡向正反应方向移动, 溶液的c(H+)增大。(3分)
Cl- + H+ + HClO,光照,HClO分解生成HCl和O2,使平衡向正反应方向移动, 溶液的c(H+)增大。(3分)
解析试题分析:本题以氯气与水的反应为载体考查化学平衡相关知识。(1)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质;反应的离子方程式为Cl2 + H2O  Cl- + H+ + HClO;(2)在1L水中可溶解0.090mol氯气,近似氯气浓度为0.090mol/L;结合平衡计算——三行式及平衡状态微粒的浓度,依据平衡常数概念计算得到;计算过程见答案;(3)加入氢氧化钠,溶液中的氢氧根离子和氢离子反应,降低了氢离子浓度,平衡正向进行;(4)气体溶解度随压强增大会增大,增大压强平衡向气体体积减小的方法进行,即平衡将向正向移动;(5) 氯水中存在平衡Cl2 + H2O
Cl- + H+ + HClO;(2)在1L水中可溶解0.090mol氯气,近似氯气浓度为0.090mol/L;结合平衡计算——三行式及平衡状态微粒的浓度,依据平衡常数概念计算得到;计算过程见答案;(3)加入氢氧化钠,溶液中的氢氧根离子和氢离子反应,降低了氢离子浓度,平衡正向进行;(4)气体溶解度随压强增大会增大,增大压强平衡向气体体积减小的方法进行,即平衡将向正向移动;(5) 氯水中存在平衡Cl2 + H2O  Cl- + H+ + HClO,光照,HClO分解生成HCl和O2,使平衡向正反应方向移动, 溶液的c(H+)增大。
Cl- + H+ + HClO,光照,HClO分解生成HCl和O2,使平衡向正反应方向移动, 溶液的c(H+)增大。
考点:考查氯气性质、化学平衡的影响因素和平衡计算。

 走进文言文系列答案
走进文言文系列答案某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁, 丁中可观察到的实验现象 。
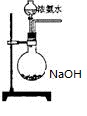
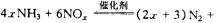
 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):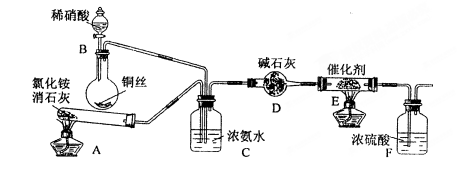

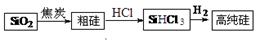
 Si(s) + 3HCl(g) ΔH>0。将一定量的反应物通入固定容积的密闭容器中进行反应。下列说法正确的是 (填字母)。
Si(s) + 3HCl(g) ΔH>0。将一定量的反应物通入固定容积的密闭容器中进行反应。下列说法正确的是 (填字母)。