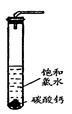
题目内容
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案: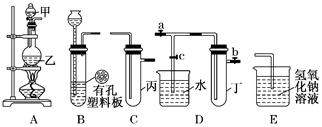
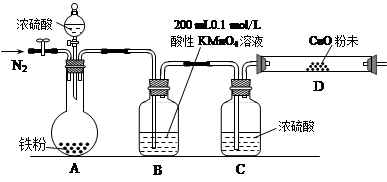
将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁, 丁中可观察到的实验现象 。
(1)① 第三周期第ⅦA族(1分,只答周期或第ⅦA族不给分)
② MnO2 + 2Cl- + 4H+ ="===" Mn2++2H2O +Cl2↑(2分,缺条件未配平共扣1分)
③ 吸收多余的Cl2(尾气处理)(1分);
④ 不合理,没有事先证明干燥的氯气有无漂白性(2分);
⑤ 不合理,制取的氯气中含HCl气体,其溶于水能与NaHCO3粉末反应产生气泡(2分)
(2)淀粉碘化钾溶液(1分)
(3)① Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(2分,未配平扣1分)
② 丁中气体的红棕色(颜色)变深(1分)
解析试题分析:氯元素处于第三周期第ⅦA族,制备氯气在实验室中,主要是用二氧化锰与浓盐酸反应来制备。氯气有毒,因此要用氢氧化钠溶液进行尾气处理。氯水之所以能使品红溶液褪色,主要是因为氯水中存在具有强氧化性的次氯酸。在实验室制备氯气时,常常混有氯化氢气体。而氯化氢气体也可以碳酸氢钠溶液反应生成二氧化碳气体。氯气的氧化性大于碘单质,而碘单质遇到淀粉会变蓝。铜可以浓硝酸反应生成棕红色气体二氧化氮。
考点:考查实验室制取氯气以及氯气与碘氧化性强弱比较的相关知识点。

(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。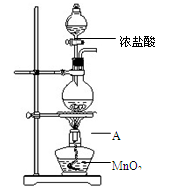
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。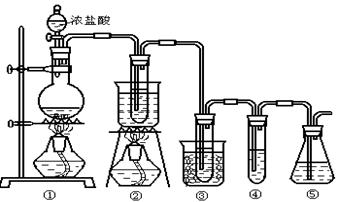
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为 色 | _________________________________________ |
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ① ② ③ ④H2O使布条退色 | ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②: ; 实验③:把红色布条放在水里,布条不退色 | |