题目内容
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释: 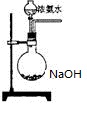
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________
(1)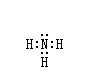 (1分)
(1分)
(2)2NH4Cl +Ca(OH)2 CaCl2+2NH3 ↑+2H2O (2分)NH4++H2O
CaCl2+2NH3 ↑+2H2O (2分)NH4++H2O NH3·H2O+H+(1分)
NH3·H2O+H+(1分)
c(Cl-) >c(NH4+) >c(H+)> c(OH-) (1分)
(3) NH3+H2O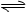 NH3·H2O
NH3·H2O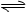 NH4++OH-
NH4++OH-
NaOH溶于水发生电离,使c(OH-)增大,平衡向生成NH3的方向移动,NH3逸出(2分)
(4) 2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+ (1分) (答案合理即给分)
3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+(1分) (答案合理即给分)
(5)N2H4- 4e—+ 4OH— =N2+4H2O (2分)
(6)3O2 + 2NO + 6NO2 + 4Ca(OH)2=4Ca(NO3)2 + 4H2O (2分)
解析试题分析:(1)N原子分别与3个H原子形成一对共用电子,电子式为: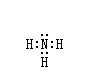
(2)实验室用Ca(OH)2与NH4Cl制取NH3,化学方程式为:2NH4Cl +Ca(OH)2 CaCl2+2NH3 ↑+2H2O;生成的产物为NH4Cl,水解显酸性,离子方程式为:NH4++H2O
CaCl2+2NH3 ↑+2H2O;生成的产物为NH4Cl,水解显酸性,离子方程式为:NH4++H2O 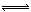 NH3?H2O+H+;NH4+水解浓度小于Cl?,溶液显酸性则H+浓度大于OH?浓度,所以c(Cl-) >c(NH4+) >c(H+)> c(OH-)。
NH3?H2O+H+;NH4+水解浓度小于Cl?,溶液显酸性则H+浓度大于OH?浓度,所以c(Cl-) >c(NH4+) >c(H+)> c(OH-)。
(3)氨水中存在平衡:NH3+H2O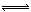 NH3·H2O
NH3·H2O 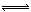 NH4++OH-,NaOH溶于水发生电离,使c(OH-)增大,并且溶解时放热,平衡向生成NH3的方向移动,NH3逸出。
NH4++OH-,NaOH溶于水发生电离,使c(OH-)增大,并且溶解时放热,平衡向生成NH3的方向移动,NH3逸出。
(4)SO2、H2O、NH3反应可生成SO32?,SO32?与Ba2+结合生成BaSO3沉淀,离子方程式为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+ ;SO2被NO3?、H+氧化为SO42?,SO42?与Ba2+结合生成BaSO4沉淀,离子方程式为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+。
(5)N2H4在碱性条件下失电子生成N2和H2O,配平可得电极方程式:N2H4- 4e—+ 4OH— =N2+4H2O。
(6)n(NO):n(NO2)=1:3,则方程式中NO与NO2的系数为1:3,可得化学方程式:3O2 + 2NO + 6NO2 + 4Ca(OH)2=4Ca(NO3)2 + 4H2O。
考点:本题考查电子式、气体的实验室制法、离子浓度比较、化学方程式和离子方程式以及电极方程式的书写、弱电解质的电离、盐类的水解。

 小学课时特训系列答案
小学课时特训系列答案直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O
 HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为: 。
(2)实验室用二氧化锰制取氯气的化学方程式为: ;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气 (填写装置的序号)。
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为: ;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是 (选填下列选项的编号字母)。
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
| CaCO3用量 | 未加CaCO3时 | 加约四分之一时 | 加一半时 | 全部加完时 |
| 读数/g | 318.3 | 325.3 | 334.5 | 359.5 |
①实验中产生的CO2气体质量为 ;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位) 。
(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子: 。
Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有 性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可) 、 。
(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。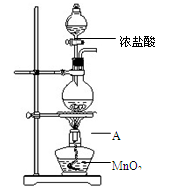
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。


 ,可能含有CO
,可能含有CO
 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;