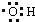题目内容
20.下列变化中一定为放热反应的是( )
| A. | N2(g)+O2(g)═2NO(g);△H=+182.6kJ•mol-1 | |
| B. | H2O(g)═H2O(l);△H=-44.0kJ•mol-1 | |
| C. | 形成化学键过程中放出256.6kJ能量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
分析 A.△H>0为吸热反应;
B.H2O(g)═H2O(l);没有发生化学反应;
C.化学反应中,放热反应旧的化学键断裂需要吸收能量小于新的化学键生成过程中会放出能量;
D.根据图示中反应物与生成物能量高低进行判断.
解答 解:A.△H>0为吸热反应,故A错误;
B.H2O(g)═H2O(l);没有发生化学反应,故B错误;
C.化学反应中,放热反应旧的化学键断裂需要吸收能量小于新的化学键生成过程中会放出能量,所以形成化学键过程中放出256.6kJ能量的化学反应,不能判断是放热反应,故C错误;
D.由图示可知,在反应过程中,反应物总能量大于生成物总能量,该反应一定为放热反应,故D正确;
故选D.
点评 本题考查了化学反应与能量变化,题目难度不大,注意明确化学反应的实质,任何化学反应中一定伴随着能量变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列叙述正确的是( )
| A. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 在铁件上镀铜时,金属铜作阴极 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |

 的名称为3,3,4-三甲基己烷
的名称为3,3,4-三甲基己烷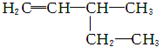 的名称为3-甲基-1-戊烯
的名称为3-甲基-1-戊烯