题目内容
10.已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b.(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,溶液的pH=7.
酸碱按体积比为1:10混合后溶液显中性,则a+b=13.
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么
A溶液中水电离出的氢离子浓度为10-10mol•L-1,
B溶液中水电离出的氢离子浓度为10-12mol•L-1
(3)若A为醋酸,B为氢氧化钠,且a=4,b=10将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA<VB.
分析 (1)HCl中c(H+)=10-amol/L,NaOH中c(OH-)=10b-14mol/L;
盐酸为强酸,氢氧化钠为强碱,酸碱按体积比为1:10混合后溶液显中性,则1×10-a=10×10b-14;
(2)根据酸或碱溶液的pH结合水的离子积常数计算氢氧根离子浓度或氢离子浓度,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度;
(3)醋酸是一元弱酸,所以醋酸的浓度远远大于氢离子浓度,根据酸和碱浓度大小确定溶液体积大小,根据电荷守恒确定钠离子和醋酸根离子浓度关系.
解答 解:(1)HCl中c(H+)=10-amol/L,NaOH中c(OH-)=10b-14mol/L,a+b=14,则c(OH-)=10amol/L,二者的浓度相同,二者等体积混合恰好反应生成NaCl,溶液显中性,则pH=7;盐酸为强酸,氢氧化钡为强碱,酸碱按体积比为1:10混合后溶液显中性,则1×10-a=10×10b-14,解得a+b=13,
故答案为:7;13;
(2)如果a=4,则醋酸溶液中C(OH-)=$\frac{Kw}{c({H}^{+})}$mol/L,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度,所以A溶液中水电离出的氢离子浓度为10-10mol/L,b=12的氢氧化钡溶液中氢离子浓度为10-12 mol/L;
故答案为:10-10,10-12;
(3)醋酸是弱电解质,所以醋酸溶液中C(H+)=10-4 mol/L<C(CH3COOH),氢氧化钠溶液中C(OH-)=10-4mol/L,要使混合后的溶液呈中性,则需要氢氧化钠的体积大于醋酸体积;
故答案为:<.
点评 本题考查了混合溶液中pH的计算,注意根据电荷守恒、水的离子积常数来解答即可,难度中等,侧重于考查学生的分析能力和计算能力.


| A. | N2(g)+O2(g)═2NO(g);△H=+182.6kJ•mol-1 | |
| B. | H2O(g)═H2O(l);△H=-44.0kJ•mol-1 | |
| C. | 形成化学键过程中放出256.6kJ能量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
| A. | 1.44 g | B. | 1.60 g | C. | 2.14 g | D. | 1.8 g |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 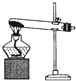 加热分解NaHCO3 | B. | 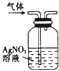 除去氯气中的少量氯化氢 | ||
| C. | 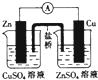 构成铜锌原电池 | D. | 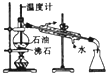 分馏石油 |
| A. | 原子半径:W>Y>Z>X | |
| B. | 最高价氧化物对应水化物的酸性:Y>W | |
| C. | 单质沸点W>Z | |
| D. | X、Y、Z不能存在与同一离子化合物中 |
| 选项 | 应用 | 解释 |
| A | 保持硫酸亚铁溶液需要加入铁钉和少量稀盐酸 | 防止Fe2+水解以及被O2氧化 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色 | BaCl2有酸性 |
| C | 在位置溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解 | 该位置溶液中一定存在SO42-或SO32- |
| D | 在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液观察并比较实验现象 | 可以探究催化剂FeCl3对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |