题目内容
9.目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.已知物质A、B、C、D、E、F有如下转化关系:

(1)试根据上述变化写出下列物质的化学式:
ANa,BCl2,
(2)请写出下列反应的化学方程式:
C+D→NaCl3NaOH+FeCl3═Fe(OH)3↓+3NaCl
E+F→NaClNa2CO3+CaCl2═CaCO3↓+2NaCl
(3)若把A投入盛有CuSO4溶液的烧杯中,烧杯中的现象是钠熔化,四处游动,有气体与蓝色沉淀生成;烧杯中反应的化学方程式有2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
(4)工业上常用B和C反应制取“84”消毒液,写出该反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
分析 由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,据此解答.
解答 解:由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2.
(1)由上述分析可知,A为Na,B为Cl2,故答案为:Na;Cl2;
(2)C+D→NaCl的化学反应为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl,
E+F→NaCl的化学反应为Na2CO3+CaCl2═CaCO3↓+2NaCl,
故答案为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(3)将钠投入到硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,反应的方程式为:2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,现象为:钠熔化呈小球,四处游动,有气体与蓝色沉淀生成,
故答案为:钠熔化成小球,四处游动,有气体与蓝色沉淀生成;2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(4)常用B和C反应制取“84”消毒液,该反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查无机物的推断,掌握钠及其化合物的性质、氯气的性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
20.下列变化中一定为放热反应的是( )


| A. | N2(g)+O2(g)═2NO(g);△H=+182.6kJ•mol-1 | |
| B. | H2O(g)═H2O(l);△H=-44.0kJ•mol-1 | |
| C. | 形成化学键过程中放出256.6kJ能量的化学反应 | |
| D. | 能量变化如图所示的化学反应 |
4. NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
(1)NaClO溶液能杀菌消毒,原因之一是其溶液中存在有效氯(HClO),写出NaClO水解的离子方程式:ClO-+H2O HClO+OH-.
HClO+OH-.
(2)NaClO溶液的杀菌效果与溶液的浓度、温度及溶液中存在的微粒有关.
①不同温度下,500mL 0.1mol?L-1NaClO溶液对1m3空间的杀菌效果如下表所示:
由上表可知,NaClO溶液在40℃时的杀菌效果明显优于20℃时,其原因是升高温度会促进ClO-的水解,使HClO浓度增大,杀菌效果增强.
②下列微粒会减弱NaClO溶液消毒效果的是cd(填字母).
a.NH4+ b.ClO- c.OH- d.SO32-
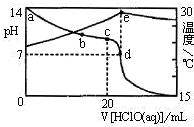
(3)室温下,将1.00mol?L-1的HClO滴入20.00mL 1.00mol?L-1NaOH溶液中,溶液的pH和温度随加入HClO体积的变化曲线如图所示.
①a、b、c、d四点中,水的电离程度最大的是c(填字母).
②下列说法中正确的是AB(填字母).
A.a、b、c、d四点溶液中d点溶液中ClO-的物质的量最大
B.c点溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
C.d点溶液中:c(Na+)=c(ClO-)+c(HClO)
D.e点后溶液温度下降的主要原因是HClO电离吸热.
 NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.
NaClO可用于水的净化、纸浆漂白、消毒等,还可在医药工业中用于制氯胺.(1)NaClO溶液能杀菌消毒,原因之一是其溶液中存在有效氯(HClO),写出NaClO水解的离子方程式:ClO-+H2O
 HClO+OH-.
HClO+OH-.(2)NaClO溶液的杀菌效果与溶液的浓度、温度及溶液中存在的微粒有关.
①不同温度下,500mL 0.1mol?L-1NaClO溶液对1m3空间的杀菌效果如下表所示:
| 温度/℃ | 20 | 30 | 40 | 80 |
| 时间/min | 10 | 10 | 10 | 10 |
| 杀菌率 | 83% | 90% | 97% | 92% |
②下列微粒会减弱NaClO溶液消毒效果的是cd(填字母).
a.NH4+ b.ClO- c.OH- d.SO32-
(3)室温下,将1.00mol?L-1的HClO滴入20.00mL 1.00mol?L-1NaOH溶液中,溶液的pH和温度随加入HClO体积的变化曲线如图所示.
①a、b、c、d四点中,水的电离程度最大的是c(填字母).
②下列说法中正确的是AB(填字母).
A.a、b、c、d四点溶液中d点溶液中ClO-的物质的量最大
B.c点溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
C.d点溶液中:c(Na+)=c(ClO-)+c(HClO)
D.e点后溶液温度下降的主要原因是HClO电离吸热.
14.有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+.已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是( )
| A. | OH-、S2-、CO32- | B. | MnO4-、SO42-、NO3- | ||
| C. | Cl-、NO3-、SO42- | D. | AlO2-、MnO4-、SO42- |
1.向200mL 0.1mol•L-1的Fe(NO3)2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,过滤,然后蒸干、灼烧沉淀到质量不再变化,此时固体的质量为( )
| A. | 1.44 g | B. | 1.60 g | C. | 2.14 g | D. | 1.8 g |
 (1)某学生课外活动小组利用图1所示装置分别做如下实验:
(1)某学生课外活动小组利用图1所示装置分别做如下实验: