题目内容
【题目】(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:_____________;不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s) ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+![]() O2(g)===Fe2O3(s)的ΔH是____________________。
O2(g)===Fe2O3(s)的ΔH是____________________。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
【答案】![]() 抑制Fe3+水解 Fe2O3 -824.35 kJ/mol B
抑制Fe3+水解 Fe2O3 -824.35 kJ/mol B
【解析】
(1)固体、纯液体不计入平衡常数表达式;
(2)FeCl3是强酸弱碱盐,水解呈酸性;加热促进氯化铁水解,氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,蒸发溶液,氯化氢挥发;
(3)根据盖斯定律计算2Fe(s)+![]() O2(g)== Fe2O3(s)的ΔH;
O2(g)== Fe2O3(s)的ΔH;
(4)该反应在常温下易于进行,反应是自发进行的氧化还原反应,该反应是反应前后气体体积减小的化合反应;
(1)平衡常数是各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不计入平衡常数表达式,Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),该反应的平衡常数表达式K=![]() ;
;
(2)铁离子水解Fe3++3H2O![]() Fe(OH)3+3H+,实验室配制FeCl3溶液时,应向其中加入少量浓盐酸抑制铁离子水解;
Fe(OH)3+3H+,实验室配制FeCl3溶液时,应向其中加入少量浓盐酸抑制铁离子水解;
氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,蒸发溶液,氯化氢挥发,得到水解产物氢氧化铁,灼烧得到氧化铁;
(3)①Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s)ΔH=+234.1 kJ/mol
CO2(g)+2Fe(s)ΔH=+234.1 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
根据盖斯定律,②×![]() - ①得2Fe(s)+
- ①得2Fe(s)+![]() O2(g)===Fe2O3(s) ΔH=-393.5 kJ/mol ×
O2(g)===Fe2O3(s) ΔH=-393.5 kJ/mol ×![]() -234.1 kJ/mol=-824.35 kJ/mol;
-234.1 kJ/mol=-824.35 kJ/mol;
(4)A.Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,该反应是能自发进行的反应,故A正确;
B.反应后气体体积减小,该反应是熵减小的反应,故B错误;
C.该反应由三种物质生成一种物质,是化合反应,故C正确;
D.反应前后铁元素、氧元素化合价发生变化,该反应是氧化还原反应,故D正确;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】实验室模拟工业生产食品香精菠萝酯(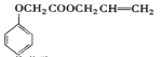 )的简易流程如下:
)的简易流程如下:
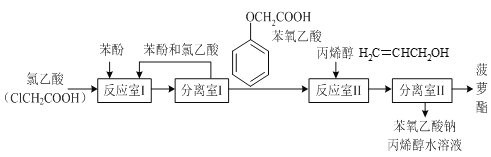
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用___(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热
(2)分离室I采取的操作名称是___。
(3)反应室I中发生反应的化学方程式是___。
(4)分离室II的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是___(用化学方程式表示)。