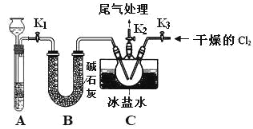
题目内容
【题目】六氟化硫(SF6)分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
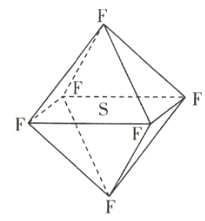
A.SF6各原子均达到最外层8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.SF6是原子晶体
【答案】C
【解析】
由六氟化硫(SF6)分子为正八面体构型(分子结构如图所示)可知六氟化硫(SF6)为分子晶体,S形成6个共价键,分子中正负电荷重心重合,以此分析。
A.S原子最外层有6个电子,在SF6分子中,S形成6个共价键,不满足最外层8电子稳定结构,故A错误;
B.SF6中S元素为+6价,无法被氧气氧化,所以SF6不易燃烧,故B错误;
C.SF6分子中含有S—F极性键,且分子中正负电荷重心重合,SF6分子是含有极性键的非极性分子,故C正确;
D.SF6形成的是分子晶体,故D错误;
故答案选:C。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为 _______(MnO4-被还原为Mn2+)
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。
① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_______(填字母)
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
共价键 | C—H | S=S | C=S | H—S |
律能/kJmol-1 | 411 | 425 | 573 | 363 |
该反应的△H _______kJmol-1
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
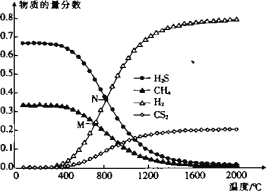
①该反应△H _______(填“>”或“<”)0。
②M点,H2S的平衡转化率为_______,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______(列举一条)。
③N点,平衡分压p(CS2)=_______MPa,对应温度下,该反应的KP =_______(MPa)2。(KP为以分压表示的平衡常数)