题目内容
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
【答案】3d104s2 b Br>As>Se>Te H2O2分子间存在氢键 sp3杂化 三角锥形 离子键 Zn2+可以通过配位键与OH—结合成为络离子 3.24×1023/(a 3NA)
【解析】
(1)锌为30号元素,据此书写基态锌(Zn)原子的电子排布式;
(2)根据“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,结合各选项分析判断;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小,据此判断Te、As、Se、Br的第一电离能的大小顺序;
(4) H2O2分子间存在氢键,而H2S分子间不能形成氢键;根据价层电子对数=σ键个数+孤电子对个数分析解答;
(5)①根据电负性的差值>1.7,形成离子键,<1.7形成共价键判断;根据[Zn(OH)4]2—中存在配位键分析解答;②根据均摊法计算ZnO晶胞中含有的Zn、O原子数,计算晶胞的质量,再计算晶胞的密度。
(1)锌为30号元素,基态锌(Zn)原子的价电子排布式为 3d104s2,故答案为:3d104s2;
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是泡利原理,故答案为:b;
(3) 同周期元素,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;同族元素,从上至下第一电离能逐渐减小。在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻,则Te、As、Se、Br的第一电离能由大到小排序为Br>As>Se>Te,故答案为:Br>As>Se>Te;
(4)H2O2和H2S的相对分子质量相等,但H2O2分子间存在氢键,沸点较高,H2S分子间不能形成氢键,使得常温下,H2O2呈液态,而H2S呈气态;![]() 的中心原子Se的价层电子对数=3+
的中心原子Se的价层电子对数=3+![]() =4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
=4,采用sp3杂化,其空间构型为三角锥形,故答案为:H2O2分子间存在氢键;sp3杂化;三角锥形;
(5)①锌元素、氧元素的电负性分别为1.65、3.5,ZnO中电负性的差值=3.5-1.65=1.85>1.7,构成离子键;Zn2+可以通过配位键与OH—结合成为络离子,导致ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,故答案为:离子键;Zn2+可以通过配位键与OH—结合成为络离子;
②ZnO晶胞中含有Zn原子数=8×![]() +6×
+6×![]() =4,O原子数=12×
=4,O原子数=12×![]() +1=4,因此晶胞的质量=
+1=4,因此晶胞的质量=![]() g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=
g,晶胞的体积=(a×10-7)3cm3,晶胞的密度=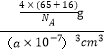 =
=![]() ×1023 g·cm3,故答案为:
×1023 g·cm3,故答案为:![]() ×1023。
×1023。

【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液